
为回收利用废钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,主要流程如下:

部分含钒物质在水中的溶解性如下:
物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |
回答下列问题:
(1)工业由V2O5冶炼金属钒常用铝热剂法,该反应的氧化剂为_____________。
(2)滤液中含钒的主要成分为______________(填化学式)。
(3)该工艺中反应③的沉淀率(又称沉钒率)是回收钒的关键之一,该步反应的离子方程式____;沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据下图判断最佳控制氯化铵系数和温度为___________、_________℃。

(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,反应方程式为:2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O,其中n、m分别为______________、________ 。
(5)全钒液流电池的电解质溶液为VOSO4溶液,电池的工作原理为: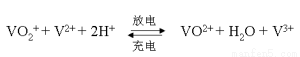
电池放电时正极的电极反应式为 。
(15分)(1)V2O5(1分)(2)VOSO4(2分)(3)NH4++VO3- =NH4VO3↓(2分);
4(2分);80(2分) (4)2(2分);2(2分) (5)VO2++ 2H++e-= VO2++H2O(2分)
【解析】
试题分析:(1)铝和五氧化二钒发生铝热反应的方程式为:3V2O5+10Al 6V+5Al2O3,反应中氧化剂是V2O5;
6V+5Al2O3,反应中氧化剂是V2O5;
(2)根据溶解性表知,V2O5难溶,VOSO4可溶,因此滤渣是V2O5,滤液中含矾的主要成分的化学式为VOSO4;
(3)根据NH4VO3难溶可知,反应③是复分解反应,方程式为NH4++VO3- =NH4VO3↓;根据图像可知氯化铵系数为4、温度为80℃时沉淀率最高,所以最佳控制氯化铵系数和温度为4和80℃。
(4)根据方程式2VO2++H2C2O4+2H+=2VOn+ + 2CO2↑+ mH2O可知草酸中碳元素的化合价从+3价升高到+4价,失去1个电子,1mol草酸失去2mol电子,则根据电子得失守恒可知氧化剂得到2mol电子,所以1mol VO2+得到1mol电子,V元素的化合价从+5价降低+4价,因此n=2;根据氢原子守恒可知m=2。
(5)放电是原电池,正极得到电子,则根据总反应式可知,放电时VO2+得到电子,电极反应式为 VO2++ 2H++e-=VO2++H2O。
考点:考查氧化还原反应的有关应用与计算、反应条件的选择以及电化学原理的应用


科目:高中化学 来源:2013-2014宁夏银川市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
次氯酸可用于杀菌消毒。已知25°C时:
①HClO(aq)+OH-(aq)= ClO-(aq)+ H2O(l) ΔH=-Q1kJ·mol-1
②H+(aq)+OH-(aq) = H2O(l) ΔH=-57.3kJ·mol-1
下列说法正确的是
A.在25°C时,次氯酸的电离方程式及热效应可表示为:
HClO(aq)=H+(aq)+ClO-(aq)ΔH=-(57.3+Q1)kJ·mol-1
B.将20ml 1mol/L HClO与10ml 1mol/L NaOH混合后的溶液,一定存在:
2C(H+)-2C(OH-)=C(ClO-)-C(HClO)
C.已知酸性H2SO3>HClO>HSO3-, 则向Na2SO3溶液中加入HClO的离子方程式为:SO32-+ HClO= HSO3-+ ClO-
D.已知酸性CH3COOH>HClO,则等浓度CH3COONa和NaClO的混合液中:
C(Na+)> C(ClO-)> C(CH3COO-)> C(OH-)> C(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:填空题
(10分)下表为元素周期表的一部分,请回答有关问题:
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 |
|
|
|
| ① |
| ② |
|
3 |
| ③ | ④ | ⑤ |
| ⑥ | ⑦ | ⑧ |
4 | ⑨ |
|
|
|
|
| ⑩ |
|
(1)⑤和⑧的元素符号是 和 。
(2)表中最活泼的金属是 ,非金属性最强的元素是 。(填元素符号)
(3)表中能形成两性氢氧化物的元素是 ,分别写出该元素形成的单质与⑥、⑨最高价氧化物的水化物反应的化学方程式: 、 。
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱: 。
查看答案和解析>>
科目:高中化学 来源:2013-2014宁夏高一下学期期中考试化学试卷(解析版) 题型:选择题
下列各表为周期表的一部分(表中为原子序数),其中正确的是( )
| 2 |
|
| 2 | 3 | 4 |
|
| 6 |
|
|
| 6 | 7 |
11 |
|
|
| 11 |
| 11 | 12 | 13 |
| 14 |
| |||
19 |
|
|
| 19 |
|
| 24 |
| 31 | 32 |
|
A、 B、 C、 D、
查看答案和解析>>
科目:高中化学 来源:2013-2014学年陕西省五校高三第三联考理综化学试卷(解析版) 题型:选择题
根据下列框图,有关说法正确的是

A.M、E都是第四周期中的过渡元素,E的金属活动性比M的金属活动性强,E3+的氧化性比M2+的氧化性弱
B.反应⑤的离子方程式可表示为:2E(OH)3 +3Cl2 +6H2O = 3EO4 2―+ 6Cl― +12H+
C.反应①、②、③、⑤都属于氧化还原反应,且在反应①和③中硫酸仅表现了酸性
D.用K2EO4、Zn可制成一种高能电池,该电池中负极的电极反应式为:
EO42―+4H2O+3e? =E(OH)3+5OH―
查看答案和解析>>
科目:高中化学 来源:2013-2014学年辽宁省东北三省高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
X、Y、Z、W、Q五种前四周期元素,原子序数依次增大。已知五种元素中只有一种为金属元素,XW2分子与Y3?为等电子体,元素W的原子序数等于元素Z的原子序数加8,Q的最外层电子数为2,次外层电子数等于Y和W2-最外层电子数之和。根据以上信息回答下列问题:
(1)X、Y、Z的电负性由大到小的顺序为 。
(2)XW2的电子式为 ,Y3?的分子构型为 型。
(3)Q的价电子排布式为 。
(4)下列关于WZ2结构的说法正确的是
A.WZ2为直线型非极性分子 B.WZ2为直线型极性分子
C.WZ2中W为sp3杂化 D.WZ2中W为sp2杂化
(5)α-QW的晶胞是立方体,用X射线粉末法测得该晶体晶胞边长a=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。
(6)α-QW晶胞的一个侧面的投影图如右图所示,与Q离子距离最近且距离相等的W离子构成的几何图形是 。

查看答案和解析>>
科目:高中化学 来源:2013-2014学年甘肃省玉门市高三第三次摸底考试化学试卷(解析版) 题型:选择题
下列依据热化学方程式得出的结论正确的是( )
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) △H=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出小于57.3 kJ的热量
B.已知2H2(g)+O2(g)=2H2O(g) △H=-483.6 kJ·mol--1,则氢气的燃烧热为241.8 kJ·mol-1
C.已知2C(s)+2O2(g)=2CO2(g) △H=a、2C(s)+O2(g)=2CO(g) △H=b,则a>b
D.已知P (白磷,s)=P (红磷,s) △H<0,则白磷比红磷稳定
查看答案和解析>>
科目:高中化学 来源:2013-2014学年湖南省益阳市高三下学期模拟考试理综化学试卷(解析版) 题型:实验题
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。

(1)写出实验室利用KMnO4分解制取O2的化学方程式
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
A.84消毒液(NaClO溶液)
B.双氧水
C.苯酚
D.75%酒精
(3)在滴定实验中,常用 (填“酸式”或“碱式”)滴定管量取KMnO4溶液。
(4)写出反应①的化学方程式
(5)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(6)上述流程中可以循环使用的物质有 、 (写化学式),鉴于此现用100吨软锰矿(含MnO287.0%),理论上可生产KMnO4晶体 吨(不考虑制备过程中原料的损失)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com