
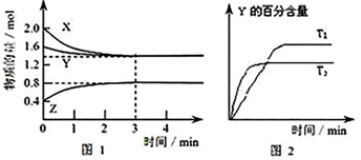
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
分析 A.根据物质的量的变化量与化学计量数成正比书写化学方程式;
B.根据3min内X的物质的量浓度的变化量计算化学反应速率;
C.图2中曲线中温度越高越优先达到平衡状态;
D.图3与图1比较,判断平衡是否发生移动,根据影响平衡移动的因素判断.
解答 解:A.根据图1可知,反应中X、Y的物质的量逐渐减小,Z的物质的量逐渐增大,所以X、Y为反应物,Z为生成物,由于该反应反应物没有完全反应,该反应为可逆反应,根据物质的量的变化量与化学计量数成正比可知X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,则该反应的化学方程式为:3X(g)+Y(g)?2Z(g),故A正确;
B.反应进行的前3min内,X的物质的量变化为:2.0mol-1.4mol=0.6mol,用X表示的反应速率为:v(X)=$\frac{\frac{06mol}{2L}}{3min}$=0.1mol/(L•min),故B错误;
C.根据图2中曲线可知,T2时先到达平衡状态,说明反应速率大,根据温度越高反应速率越大说明T2温度高,故C正确;
D.图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂,故D正确;
故选B.
点评 本题考查化学平衡的计算,题目难度中等,明确图象曲线变化的含义为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及化学计算能力.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:选择题
| A. | NaAlO2溶液中加入过量氨水 | |
| B. | Al 2(SO 4) 3溶液中加入过量KOH溶液 | |
| C. | FeCl2溶液中加入过量氨水 | |
| D. | MgSO4溶液中加入过量KOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改用锌粉 | B. | 滴入几滴硫酸铜溶液 | ||
| C. | 加入少量1mol•L-1稀硫酸 | D. | 加入少量NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用碱式滴定管量取10.15 mL KMnO4溶液 | |
| B. | 在FeBr3溶液中通入Cl2以除去其中FeCl2杂质 | |
| C. | 用FeCl3溶液检验KC1中是否含有KSCN杂质 | |
| D. | 常温下将铝片和铜片分别放入浓硝酸中以证明铝比铜活泼 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
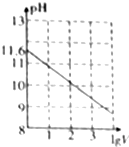 常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )
常温下,1ml 0.10mol•L-1K2CO3溶液,加水稀释至体积为Vml,pH随lgV的变化情况如图所示,下列叙述中正确的是( )| A. | 0.10mol•L-1的K2CO3溶液中由水电离出的c(OH-)═10-11.6mol•L-1 | |
| B. | 0.10 mol•L-1的K2CO3溶液中:2c(K+)═c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 当lgV=2时,若K2CO3溶液升高温度,溶液碱性增强,$\frac{c(HC{{O}_{3}}^{-})}{c(C{{O}_{3}}^{2-})}$-)减小 | |
| D. | 当lgV=3时,K2CO3溶液中:c(OH-)═c(H+)+c(HCO3-)+2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
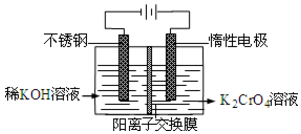 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )| A. | 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+2O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=$\frac{d}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+2H+═Cu2++H2O | B. | CaCO3+2H+═Ca2++CO2↑+H2O | ||
| C. | Fe+2H+═Fe2++H2↑ | D. | Ba(OH)2+2H+═Ba2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com