
 常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.
常温下,10mL pH均为2的HX、HY两种一元酸溶液,加水稀释过程中溶液的pH随溶液体积变化曲线如图所示.分析 (1)pH=2的盐酸,稀释100倍后溶液的pH变为4;
(2)由图可知,稀释时HX的pH变化大,则酸性HX>HY,NaX和NaY溶液促进水的电离,结合对应酸越弱,水解程度越大分析;
(3)0.1mol•L-1的HY溶液中加入等体积pH=l的盐酸后,抑制HY的电离,溶液中氢离子浓度增大;
(4)常温下,0.1mol•L-1的H2Z溶液中加入等体积pH=13的KOH溶液后,生成KHZ,溶液的pH<7,则HZ-电离大于其水解程度.
解答 解:(1)HCl为强电解质,pH=2的盐酸稀释100倍后,溶液的pH变为4,则溶液pH变化趋势为: ,
,
故答案为: ;
;
(2)由图可知,稀释时HX的pH变化大,则酸性HX>HY,NaX和NaY溶液促进水的电离,水解显碱性,NaX水解程度小,其pH小,
故答案为:NaX;
(3)0.1mol•L-1的HY溶液中加入等体积pH=l的盐酸后,抑制HY的电离,所以HY的电离程度减小,而溶液中氢离子浓度增大,所以pH降低,
故答案为:降低;
(4)常温下,0.1mol•L-1的H2Z溶液中加入等体积pH=13的KOH溶液后,生成KHZ,溶液的pH<7,则HZ-电离程度大于其水解程度,
故答案为:HZ-的电离程度大于水解程度.
点评 本题考查弱电解质的电离平衡及其影响,题目难度中等,涉及酸碱混合pH的计算、盐类水解、水的电离等知识,注意掌握弱电解质的电离平衡及其影响因素,试题综合考查学生分析解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
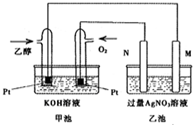 在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.
在298K时,1mol C2H5OH在氧气中完全燃烧生成二氧化碳和液态水放出热量1366.8kJ.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;反应类型酯化反应会取代反应;
;反应类型酯化反应会取代反应;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.3克金属钠在干燥空气中被氧化成氧化物时失去的电子数目为0.1NA | |
| B. | 18克水所含的质子数目为NA | |
| C. | 在常温常压下,11.2升氯气所含的分子数目为0.5NA | |
| D. | 32克臭氧所含的原子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com