
��X��Y��Z����Ԫ�أ����У�X�ĸ��������ӵ�ԭ�Ӻ�������Ų���믵�ԭ�Ӻ�������Ų���ͬ��Y�������������ˮ��Һ��Ϊ���ԡ���Y�������������У�Y�������ֱ���74.19%��58.97�����������������Ħ�������ֱ���62g��mol-1��78g��mol-1����X��Y�����������ˮ��Һ�еμ�Z���ʵ�ˮ��Һ����Һ����ɫ��Ϊ���ɫ��Z��X��ͬһ���壬���2�����ڡ��Իش�
(1)Y������������Ϊ________��________
(2)X��Y�������ˮ��Һ�м���Z���ʵ�ˮ��Һ�������ӷ���ʽΪ________
(3)�õ���ʽ��ʾY����������Ϊ74.19������������γɹ���________
(1)Na2O�� Na2O2 (2)Cl2+2I- = I2+2Cl- (3)
|
����ؼ��ǵ�Ԫ������Ԫ�ص�ȷ������Ԫ�ص�ȷ����һͨ��X�����������ԭ�Ӻ�������Ų���ͬ��֪���ڵ������ڣ����ͨ��X��Y�Ļ�����ͬZ���ʷ�Ӧ�����ɫ��Һ--��ˮ��������ɫ��ȷ��XΪ��Ԫ�أ�Z��ȻΪ��Ԫ�أ���Ԫ�ص�ȷ�����ϼ������ۡ������⣬�����������зֱ���Ϊ��
|


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
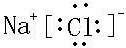
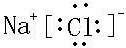
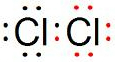
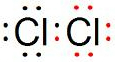
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com