
【题目】已知FeCl3溶液与KI溶液的反应为可逆反应,某小组同学对该反应进行实验探究。
(1)甲同学首先进行了实验1。
实验 1 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴(1滴约为0.05 mL,下同)。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液不显红色。 |
① 写出FeCl3溶液与KI溶液反应的离子方程式_______________________。
② 加入KSCN溶液的目的是_______________________________________。
③ 甲同学认为溶液不显红色的原因是反应体系中c(Fe3+)太低,改进实验方案,进行实验2。
实验2 | 实验步骤 | 实验现象 |
ⅰ. 取2 mL 0.1 mol·L-1 KI溶液, 滴加0.1 mol·L-1 FeCl3溶液3滴。 | ⅰ. 溶液呈棕黄色。 | |
ⅱ. 向其中滴加2滴0.1 mol·L-1 KSCN溶液。 | ⅱ. 溶液显红色。 | |
ⅲ. 继续加入2 mL CCl4,充分振荡、静置。 | ⅲ. 液体分层,上层红色消失,变为棕黄色,下层呈紫红色。 |
本实验改用0.1 mol·L-1 KI溶液的目的是_________________________________________。
用化学平衡原理解释实验2中加入CCl4后上层溶液红色消失的原因________________。
(2)甲同学认为“用CCl4萃取后上层溶液仍为棕黄色”的原因是I2未被充分萃取,但乙同学查阅资料得到信息:I2、I3-在水中均呈棕黄色,两者有如下关系:I2+I-![]() I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
I3-。于是提出假设:萃取后的溶液呈棕黄色的主要原因是存在I3-。
① 为验证假设,乙同学设计并完成了实验3。
实验3 | 实验步骤 | 实验现象 |
ⅰ. 取1 mL实验2中棕黄色的上层清液,再加入2 mL CCl4, 振荡、静置。 | ⅰ. 液体分层,上层呈黄色,下层呈紫红色。 | |
ⅱ. 取1 mL饱和碘水,加入2 mL CCl4, 振荡、静置。 | ⅱ. 液体分层,上层为无色,下层呈紫红色。 |
实验3的结论是_________________________________。
② 甲同学依据乙同学的实验设计思路,选用实验2中的试剂,运用控制变量的方法设计了更加严谨的实验,证明了平衡I2+I-![]() I3-的存在。
I3-的存在。
请你补充完整他设计的实验步骤:将实验2中下层紫红色溶液平均分成两份,分装于两支试管中,向试管1中加入1 mL水,振荡、静置;向试管2中_________________。两支试管中的现象分别为__________________________________。
【答案】2Fe3++2I- ![]() 2Fe2++I2 检验溶液中是否大量存在Fe3+ 提高平衡时溶液中的c(Fe3+) 加入CCl4后,I2被CCl4萃取,平衡2Fe3++2I—
2Fe2++I2 检验溶液中是否大量存在Fe3+ 提高平衡时溶液中的c(Fe3+) 加入CCl4后,I2被CCl4萃取,平衡2Fe3++2I—![]() 2Fe2++I2正向移动,或c(Fe3+)降低,平衡Fe3++3SCN—
2Fe2++I2正向移动,或c(Fe3+)降低,平衡Fe3++3SCN—![]() Fe(SCN)3逆向移动,或c[Fe(SCN)3]降低,所以红色消失 萃取后的溶液呈棕黄色的主要原因是存在I3- 加入1 mL 0.1 mol·L-1 KI溶液,振荡、静置 试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,下层呈紫红色(或紫红色变浅)
Fe(SCN)3逆向移动,或c[Fe(SCN)3]降低,所以红色消失 萃取后的溶液呈棕黄色的主要原因是存在I3- 加入1 mL 0.1 mol·L-1 KI溶液,振荡、静置 试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,下层呈紫红色(或紫红色变浅)
【解析】
试题(1)①根据FeCl3溶液与KI溶液的反应为可逆反应,化学方程式为 2FeCl3+2KI2KCl+2FeCl2+I2,离子方程式是2Fe3+ +2I-2Fe2+ +I2;②检验Fe3+常用的试剂是KSCN溶液,向溶液中滴入KSCN溶液,Fe3++3SCN-Fe(SCN)3,溶液变为血红色。所以,此处加入KSCN溶液的目的是检验溶液中是否大量存在Fe3+;③FeCl3溶液与KI溶液的反应为可逆反应,c(I-)降低,平衡向左移动,c(Fe3+)增大,进而验证甲同学的想法;在溶液中存在两个平衡:平衡1:2Fe3++ 2I- 2Fe2++I2, 平衡2:Fe3++ 3SCN- Fe(SCN)3,加入CCl4后,I2被CCl4萃取,c(I2)减小,平衡1向右移动,c(Fe3+)减小,平衡2向左移动,c[Fe(SCN)3]降低,红色消失;
(2)①由实验3可知,再向1 mL实验2中棕黄色的溶液中加2 mL CCl4,上层黄色溶质仍不能被萃取,同样的向1 mL饱和碘水中加入2 mL CCl4,却能够将碘水萃取为无色,证明萃取后的溶液呈棕黄色的主要原因是存在I3-,而不是I2;②要证明平衡I2+I-![]() I3-的存在,需把试管1作为参照,向试管2提供与实验2完全相同的KI溶液,所以加入的是1 mL0.1 mol·L-1KI溶液,试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,即生成了I3-,下层呈紫红色(或紫红色变浅)。
I3-的存在,需把试管1作为参照,向试管2提供与实验2完全相同的KI溶液,所以加入的是1 mL0.1 mol·L-1KI溶液,试管1中液体分层,上层为无色,下层呈紫红色,试管2中液体分层,上层呈黄色,即生成了I3-,下层呈紫红色(或紫红色变浅)。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(1)如图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:_______________________________________________________。
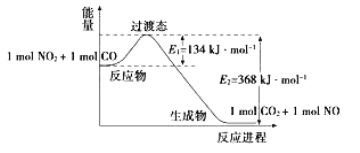
(2)总反应:Pb + PbO2 + 2H2SO4 = 2PbSO4 + 2H2O写出下列的电极反应式
负极:_____________________________
正极:_____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池产生电流的本质原因是( )
A. 电解质溶液中有电离出的自由移动的离子
B. 有导线将两个活泼性不同的电极连接
C. 在不同金属的两极间存在电势差
D. 在原电池中发生了氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内,关于下列萜类化合物的说法正确的是
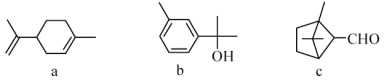
A. a和b都属于芳香族化合物
B. b的一氯代物有5种
C. a、b和c均能和氢气在一定条件下发生加成反应
D. a和c分子中所有碳原子均处于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 煤矿内瓦斯、煤气、油田气中都含有甲烷
B. 农村沼气池产生的可燃气体是甲烷
C. 煤矿坑气是植物残体经微生物发酵而产生
D. 甲烷是天然气的主要成分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知液氨能和NaH反应放出H2:NaH + NH3 =NaNH2 + H2↑,它也能和Na反应放出H2。据此下列说法中错误的是( )
A. 液氨和NaH反应中,液氨是氧化剂
B. 液氨和NaH反应生成的H2既是氧化产物又是还原产物
C. 液氨和Na反应产物中有NaNH2
D. 液氨和NaH或Na反应都属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素包括碳、硅、锗(Ge)、锡(Sn)、铅等,它们的单质及化合物广泛应用于我们生活的各个领域。锗和锡以前曾被用于半导体材料,铅被用来制造蓄电池。碳族元素在化合物中只有铅以低价形式存在时较稳定,其它元素在化合物中都是以高价形式存在比较稳定,回答下列问题:
I.(1)高岭土的成分中含Al2(Si2O5)(OH)4,请改写成氧化物的形式_________________.
(2)实验室用单质锡粉制取少量二氯化锡溶液,制取和保存的方法是(用文字叙述)_______________________________
(3)铅有多种氧化物,写出四氧化三铅与浓盐酸反应的离子方程式_____________________ .二氧化铅在空气中强热会得到一系列铅的其它氧化物。若把239g二氧化铅强热,当质量变为231g时,写出反应的化学方程式____________________________.
II.CH4–CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
CH4–CO2催化重整反应为:CH4(g)+ CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)= CH4 (g) ΔH=–75 kJ·mol1 ①
C(s)+O2(g)=CO2(g) ΔH=–394 kJ·mol1 ②
2C(s)+O2 (g)=2CO(g) ΔH=–222kJ·mol1 ③
(1)有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(2)若该反应在容积不变的绝热容器中进行,能够判断该反应已达到平衡的是____(填标号)。
A.c(CO2)/c(H2)不再发生变化
B.气体的密度不再发生变化
C.气体的平均摩尔质量不再发生变化
D.每有8molC-H键生成的同时有4molH-H键的断裂 E.容器的温度不再发生变化
(3)T℃时,在体积为10 L的容器中加入10 mol CH4、5 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,此温度下,该反应的化学平衡常数K=_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化硼是一种超硬耐磨涂层材料,右图为其晶胞,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A. 磷化硼晶体的熔点很低
B. 磷化硼晶体的化学式为BP,属于离子晶体
C. 磷化硼晶体中每个原子均形成4条共价键
D. 磷化硼晶体结构中微粒的空间堆积方式与氯化钠相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com