
【题目】下列说法正确的是( )。
A. 原子半径大小:Ca>S
B. 金属性强弱:Na<Mg
C. 酸性强弱:HBrO4>HClO4
D. 碱性强弱:NaOH> KOH
科目:高中化学 来源: 题型:
【题目】给出下列氧化还原反应,试回答下列问题。
(1)KMnO4+ KI+ H2SO4 K2SO4+ MnSO4 + I2十 H2O
配平化学反应方程式 被还原的元素 ,发生氧化反应的物质 。
(2)3Cl2 + 6NaOH![]() 5NaCl + NaClO3 + 3H2O
5NaCl + NaClO3 + 3H2O
用双线桥标出电子转移的方向和数目 氧化剂与还原剂的物质的量之比为 ,氧化产物是 。
(3)11P+15CuSO4+24H2O=6H3PO4+15H2SO4+5Cu3P(反应中Cu3P中的P为负三价)。
该反应中Cu2+表现 性(填氧化或还原);11molP中被P氧化的P是 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组设计的实验室制取乙酸乙酯的装置如下图所示。下列说法错误的是
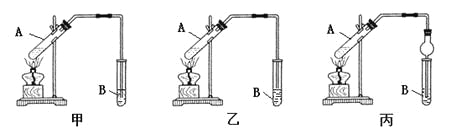
A. 上述实验装置正确且能顺利完成实验的是乙和丙
B. 试管B内盛放的液体是NaOH溶液
C. 在试管A中应加几块碎瓷片以防止A中的液体加热时发生暴沸
D. 反应结束后振荡试管B,B中液体分为两层,上层为无色油状液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列结构简式,回答下列问题:
Ⅰ、乙酸的结构简式为
(1)a、c的名称是__________、___________。
(2)b与c组成的原子团的名称是________________。
Ⅱ、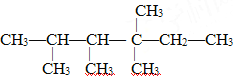
(3)该有机物名称是__________________________。
(4)此有机物为烯烃加成的产物,则原来烯烃的结构可能有_______种。
III、某芳香族化合物的分子式为C7H8O
(5)根据下列实验现象确定其结构简式(要求:每小题只需给出一个答案即可。)
①不能与金属钠反应,其结构简式_____________ ______________。
②能与钠反应,但遇FeCl3不显色______________ __ __ ________。
③能与钠反应且遇FeCl3显紫色__________________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。

下列说法不正确的是( )
A.盐桥中的K+移向FeCl3溶液
B.反应开始时,乙中石墨电极上发生氧化反应
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用O2将HCl转化为Cl2,可提高效益,减少污染。传统上该转化通过如图所示的催化剂循环实现,
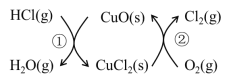
其中,反应①为:2HCl(g) + CuO(s)![]() H2O(g)+CuCl2(s) △H1
H2O(g)+CuCl2(s) △H1
反应②生成1molCl2(g)的反应热为△H2,则总反应的热化学方程式为(反应热用△H1和△H2表示)。
II.氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s) + SO2(g)=ZnSO3(s),试回答下列问题:
(1)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②_______________________;
(2)已知:纯ZnO的悬浮液pH约为6.8。用氧化锌吸收法脱去烟气中SO2的过程中,测得pH、吸收效率η随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
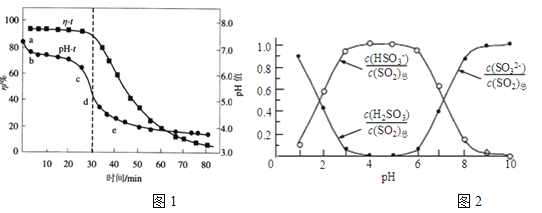
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;
④为提高SO2的吸收效率η,可采取的措施为___________。
A.增大悬浊液中ZnO的量
B.适当提高单位时间内烟气的循环次数
C.调节溶液的pH至6.0以下
(3)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
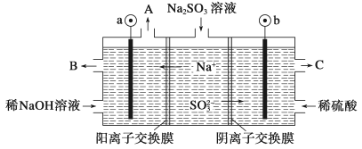
b极的电极反应式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组元素的性质递变情况错误的是( )
A. Li、C、O原子最外层电子数依次增加
B. P、S、Cl元素最高正化合价依次升高
C. N、O、F原子半径依次增大
D. Li、Na、K的金属性依次增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2) 一定条件下,将NO2与SO2以体积比1:2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是 。
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 molNO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com