
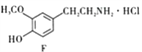
【题目】盐酸多巴胺是选择性血管扩张药,临床上用作抗休克药,合成路线如图所示:

根据上述信息回答:
(1)D的官能团名称为________________________________。
(2)E的分子式为_________________________。
(3)若反应①为加成反应,则B的名称为__________________。
(4)反应②的反应类型为___________________________。
(5)D的一种同分异构体K用于合成高分子材料,K可由HOO![]() CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
CH2Cl制得,写出K在浓硫酸作用下生成的聚合物的化学方程式:_______________________________________。
(6)E生成F的化学反应方程式为________________________。
(7)D的同分异构体有多种,同时满足下列条件的有____种。
I.能够发生银镜反应;
II.遇FeCl3溶液显紫色;
III.苯环上只有两种化学环境相同的氢原子。
【答案】 羟基、醚键、醛基 C9H9NO4 甲醛 氧化反应 nHOOC![]() CH2OH
CH2OH![]() HO
HO![]() OC
OC![]() CH2O
CH2O![]() +(n-1)H2O。
+(n-1)H2O。 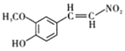 +4H2+HCl
+4H2+HCl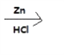
 +2H2O 19
+2H2O 19
【解析】(1)根据D的结构可知D中含有的官能团有:羟基、醚键、醛基。
(2)根据E的结构简式可知E的分子式为:C9H9NO4。
(3)A的分子式为C7H8O2,C7H8O2与B发生加成反应生成化合物C8H10O3,可知B的分子式为CH2O,所以B的结构简式为HCHO,名称为甲醛。
(4)A与HCHO加成得到的产物为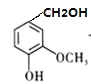 ,根据D的结构可知
,根据D的结构可知 发生氧化反应,故反应②的反应类型为氧化发应。
发生氧化反应,故反应②的反应类型为氧化发应。
(5)HOO![]() CH2Cl在NaOH水溶液中加热发生水解反应生成物质K :HOOC
CH2Cl在NaOH水溶液中加热发生水解反应生成物质K :HOOC![]() CH2OH,HOOC
CH2OH,HOOC![]() CH2OH在浓硫酸的作用下发生缩聚反应: nHOOC
CH2OH在浓硫酸的作用下发生缩聚反应: nHOOC![]() CH2OH
CH2OH ![]()
HO ![]() OC
OC![]() CH2O
CH2O![]() +(n-1)H2O。
+(n-1)H2O。
(6)E到F的过程中,碳碳双键与H2发生加成反应,-NO2与H2发生还原反应生成-NH2,所以化学方程式为: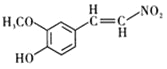 +4H2 +HCl
+4H2 +HCl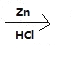
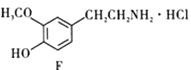 +2H2O。
+2H2O。
(7)分情况讨论:
(1)当含有醛基时,苯环上可能含有四个取代基,一个醛基、一个甲基、两个羟基:
a:两个羟基相邻时,移动甲基和醛基,共有6种结构。
b:两个羟基相间时,移动甲基和醛基,共有6种结构。
c:两个羟基相对时,移动甲基和醛基,共有3种结构。
(2)当含有醛基时,苯环上有两个对位的取代基,一个为-OH,另一个为-O-CH2-CHO或者一个为-OH,另一个为-CH2-O-CHO,共有2种结构。
(3)当含有醛基时,有两个对位的取代基,一个为-OH,另一个为-CH(OH)CHO,共1种结构。
(4)当含有甲酸某酯的结构时,苯环上只有两个取代基,一个为羟基,一个为-CH2OOCH,所以有1种结构。
故符合条件的同分异构体总共有6+6+3+2+1+1=19种。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】常温下,向 20 mL 0.1 mol·L-1 的 CH3COOH 溶液中不断滴入 0.1 mol·L-1 的 NaOH溶液,溶液的pH变化曲线,如图所示。在滴定过程中,关于溶液中离子浓度大小关系的描述错误的是
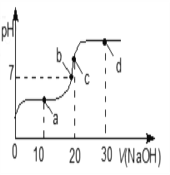
A. a 点时: c( CH3COO-)>c( Na+)>c( H+)>c( OH-)
B. b 点时:c( Na+) =c( CH3COO-)>c(H+)=c( OH-)
C. c 点时:c(OH-)=c(CH3COOH) +c(H+)
D. d 点时:c(Na+)> c(OH-) > c(CH3COO-) >c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯和乙烯都是石油化工最重要的基础原料,可用于生产多种重要的有机化工产品。主要的工业生产途径如下:
途径I:CH3CH2CH3(g) ![]() CH2=CHCH3(g)+H2(g) △H1
CH2=CHCH3(g)+H2(g) △H1
途径II :nCH3OH(g) ![]() CnH2n(g)+nH2O(g)(n为2或3) △H2<0
CnH2n(g)+nH2O(g)(n为2或3) △H2<0
回答下列问题:
(1)已知:丙烷、丙烯、氢气的燃烧热分别为2219.9 kJ·mol-1 、2056.5 kJ·mol-1 和285.8 kJ·mol-1 ,则△H1=________ kJ·mol-1 。
(2)途径I制备丙烯,要提高丙烯的产率最好采用____________条件。(填“高压”或“低压”)
(3)途径II控制适当的条件(温度、压强、催化剂等)可以调节N(N=n(乙烯)/n(丙烯))在0~1.5之向变化,回答下列问题:
①要大幅度提高丙烯在最终产物中的比率,需要控制的适当条件是______________________。
②在体积为1m3的反应器中投入0.64t甲醇,1h 后,反应器中的压强增加了30%,则甲醇的转化率为______(用N=1进行计算)。
(4)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 和CO2,负极通入丙烷,电解质是熔融碳酸盐。
①写出该电池负极的电极反应式:_____________,CO32-移向电池的___极 (填“正”或“负”)。
②当电池消耗0.005mol C3H8时,正极消耗气体的总体积为_____L (标准状况下)。
③用该电池电解1000mL1mol/L的AgNO3溶液、此电解池的总反应方程式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO﹣和ClO3﹣两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示.下列说法不正确的是( ) 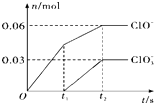
A.Cl2和苛性钾溶液在不同温度下可能发生不同反应
B.反应中转移电子数为是0.21 NA
C.原苛性钾溶液中KOH的物质的量无法确定
D.生成物中Cl﹣的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,热化学方程式中反应热数值最大的是
A.2W(l)+Y(l)→2Z(g) +Q1B.2W(g)+Y(g)→2Z(l) +Q2
C.2W(g)+Y(g)→2Z(g) +Q3D.2W(l)+Y(l)→2Z(l) +Q4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯和苯的叙述中,错误的是( )
A. 乙烯能发生加聚反应 B. 乙烯可以燃烧
C. 苯能使酸性高锰酸钾溶液褪色 D. 苯分子中6个碳碳化学键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组的同学用图所示的实验装置进行电解反应,电解槽内装有KI﹣淀粉溶液,中间用阴离子交换膜隔开.在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅.
已知:3I2+6OH﹣═IO3﹣+5I﹣+3H2O
回答下列问题:
(1)左侧为电源极.(填“正”或“负”)
(2)请用方程式及必要的文字解释左侧溶液变蓝色的原因? .
(3)写出右侧发生的有关电极反应的反应式: .
(4)电解反应结束时,左侧溶液中还I﹣ . (填“有”或“没有”)
(5)写出电解槽内发生反应的总化学方程式: .
(6)如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总化学反应 . (填“变”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 K2=5.6×10﹣11molL﹣1 | 3.0×10﹣8 molL﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为_____。
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是_______(填字母序号,下同).
A.c(H+) B.![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D.![]() E.
E. 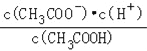
若升高该溶液温度(不考虑醋酸挥发),上述5种表达式的数据增大的是_____.
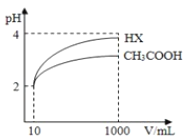
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数_____(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中水电离出来的c(H+)_____(填“大于”、“等于”或“小于”)醋酸的溶液中水电离出来的c(H+),理由是_____.
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液PH=7,该溶液显_____(填“酸”、“碱”或“中”)性.将此温度下PH=1的H2SO4溶液aL与PH=11的NaOH溶液bL混合,若所得混合液PH=2,则a:b=_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com