

 、B
、B .
. ,③
,③ .
.科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:填空题
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
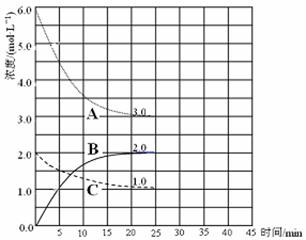
① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是_________(填序号)。
a.通入1molN2 b. 通入1molH2 c. 通入1molHe气
d. 通入1molNH3 e. 通入1molHCl f. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是_________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如右图所示。

请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是__________,导致这种规律的原因是___________。
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
化学实验中,常将溶液或试剂进行酸化,下列酸化处理的措施中正确的是
A. 定性检验SO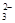 ,可用HNO3酸化的BaCl2溶液
,可用HNO3酸化的BaCl2溶液
B. 为了提高KMnO4溶液的氧化能力,可用盐酸将其酸化
C. 检验某溶液中是否含Cl–,用HNO3酸化的AgNO3溶液
D. 配制FeCl2溶液时通常加少量H2SO4酸化,减小其水解程度
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
已知:SO32-+I2+H2O→SO42-+2I-+2H+。某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等。向该无色溶液中滴加少量溴水,溶液仍呈无色。下列关于该溶液的判断正确的是
A.肯定不含I- B.肯定不含SO42-
C.肯定不含有SO32- D.肯定含有NH4+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
下列实验操作中,主要不是从安全因素考虑的是( )
A. 点燃氢气前一定要检验氢气的纯度
B. 未使用完的白磷要随时收集起来,并与空气隔绝
C. 酒精灯不用时,必须盖上灯帽
D. 用氢气还原氧化铜时,要先通一会儿氢气,再加热氧化铜
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
; ;
; (写出2种即可).
(写出2种即可).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 27 mg | B. | 54 mg | C. | 108 mg | D. | 216 mg |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;“溶解”后铜元素的主要存在形式是Cu2+(填离子符号).
;“溶解”后铜元素的主要存在形式是Cu2+(填离子符号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com