
【题目】下列有机物的结构表示不正确的是( )
A.CH4的球棍模型示意图为: ![]()
B.乙烯的实验式为:CH2
C.乙醇的结构简式:C2H5OH
D.2﹣乙基﹣1,3﹣丁二烯分子的键线式: ![]()
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100ml 3.0mol/L 稀硫酸的实验步骤如下:①计算所用浓硫酸的体积,②量取一定体积的浓硫酸,③溶解,④检漏、转移、洗涤,⑤定容、摇匀.回答下列问题:
(1)所需浓硫酸的体积是(保留到小数点后一位),量取浓硫酸所用的量筒的规格是(从下列中选用:A.10ml B.25ml C.50ml D.100ml)
(2)在上述实验步骤中,需要用到玻璃棒的有(填序号).
(3)第⑤步实验的操作是:继续向容量瓶注入蒸馏水至离刻度线1﹣2cm处,改用胶头滴管向容量瓶滴加至为止.塞紧瓶塞,倒转摇匀.
(4)下列情况对所配制的稀硫酸浓度有何影响?(填“偏大”、“偏小”或“无影响”) A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.所用过的烧杯、玻璃棒未洗涤
D.定容时俯视溶液的凹液面 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C2H6O的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是( )
A.红外光谱
B.核磁共振氢谱
C.质谱法
D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于仪器使用的说法正确的是( )
A.滴定管装滴定液时应先用蒸馏水洗净
B.锥形瓶用作反应容器时一定不能加热
C.蒸馏时温度计水银球可以高于蒸馏烧瓶支管口
D.振荡分液漏斗时应关闭玻璃塞和活塞
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. 铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉:Fe3++Fe=2Fe2+
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将适量铁粉放入三氯化铁溶液中,完全反应后,溶液中的Fe2+和Fe3+的物质的量浓度相等,则已反应的Fe3+和未反应的Fe3+的物质的量之比是
A. 2︰3 B. 3︰2 C. 1︰2 D. 1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同物质的量的下列有机物,充分燃烧,消耗氧气量相同的是( )
A.C3H4和C2H6
B.C3H6和C3H8O2
C.C3H6O2和C3H8O
D.C3H8O和C4H6O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究PM 2.5、SO2、NOx等,对监测空气质量具有重要意义.取某样本用蒸馏水处理制成待测液,其中所含离子的化学组分及其浓度如下表:
离子 | K+ | Na+ | NH4+ | H+ | SO42﹣ | NO3﹣ | Cl﹣ |
浓度/molL﹣1 | 4×10﹣6 | 6×10﹣6 | 2×10﹣5 | a | 4×10﹣5 | 3×10﹣5 | 2×10﹣5 |
请回答下列问题:
(1)根据表中数据计算此待测液中c(H+)浓度a为mol/L.
(2)NOx是汽车尾气中的主要污染物之一. ①汽车发动机工作时的高温会引发N2和O2反应,反应的化学方程式是 .
②NOx能形成酸雨,由NO2形成酸雨的主要反应是(写离子方程式).
(3)为减少SO2的排放,常采取的措施有: ①在燃煤中加入生石灰可以起到固硫的作用,SO2被吸收后转化成一种硫元素的最高价态的化合物,该物质的化学式是 .
②吸收烟气中的SO2 , 以下物质可作吸收剂的是(填序号);硫酸工业中的尾气SO2可以循环利用,写出SO2转化为SO3反应的化学方程式 . a.NaOH b.H2SO4 c.NaHSO3 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图图示与对应的叙述相符的是( ) 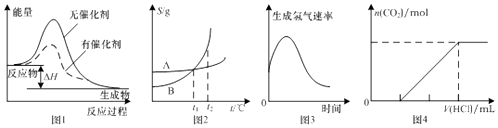
A.图1表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化
B.图2表示A,B两物质的溶解度随温度变化情况,将t1℃时A,B的饱和溶液分别升温至t2℃时,溶质的质量分数B>A
C.图3表示镁条放入盐酸中生成氢气速率随时间的变化,起初反应速率加快的原因可能是该反应为放热反应
D.图4表示在含等物质的量NaOH,Na2CO3的混合溶液中滴加0.1 molL﹣1盐酸至过量时,产生气体的体积与消耗盐酸的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com