
【题目】已知:①RNH2+R′CH2Cl ![]() RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如:
RNHCH2R′+HCl(R和R′代表烃基) ②苯的同系物能被高锰酸钾氧化,如: ![]()
![]()
![]()
③ ![]()
![]()
![]() (苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示:
(苯胺,弱碱性,易被氧化)化合物C是制取消炎灵(祛炎痛)的中间产物,其合成路线如图所示: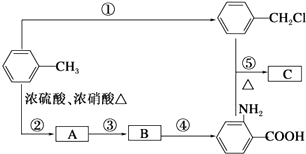
请回答下列问题:
(1)B物质的结构简式是 .
(2)写出反应①、②的化学方程式: ①;
② .
(3)反应①~⑤中,属于取代反应的是(填反应序号).
【答案】
(1)
(2) ;
;
(3)①②⑤
【解析】解:甲苯在光照条件发生甲基上取代反应生成 ![]() ,由A系列反应得到
,由A系列反应得到  ,反应中引入﹣COOH、﹣NH2 , 且处于邻位,甲基氧化得到﹣COOH,由题目信息可知,﹣NO2还原得到﹣NH2 , 由于苯胺易被氧化,所以用KMnO4(H+)先氧化﹣CH3成﹣COOH,再将﹣NO2还原得到﹣NH2 , 故A转化得到B是甲苯的硝化反应,可知A为
,反应中引入﹣COOH、﹣NH2 , 且处于邻位,甲基氧化得到﹣COOH,由题目信息可知,﹣NO2还原得到﹣NH2 , 由于苯胺易被氧化,所以用KMnO4(H+)先氧化﹣CH3成﹣COOH,再将﹣NO2还原得到﹣NH2 , 故A转化得到B是甲苯的硝化反应,可知A为  ,B为
,B为 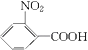 ,
,  和
和 ![]() 发生取代反应生成C,由信息(1)可知生成C为
发生取代反应生成C,由信息(1)可知生成C为 ![]() .(1)B物质的结构简式是
.(1)B物质的结构简式是  ,故答案为:
,故答案为:  ;(2)反应①的化学方程式为:
;(2)反应①的化学方程式为:  ;反应②的化学方程式为:
;反应②的化学方程式为:  ,
,
故答案为:  ;
;  ;(3)反应①~⑤中,①②⑤属于取代反应,反应③属于氧化反应,反应④属于还原反应,
;(3)反应①~⑤中,①②⑤属于取代反应,反应③属于氧化反应,反应④属于还原反应,
故答案为:①②⑤.
甲苯在光照条件发生甲基上取代反应生成 ![]() ,由A系列反应得到
,由A系列反应得到  ,反应中引入﹣COOH、﹣NH2 , 且处于邻位,甲基氧化得到﹣COOH,由题目信息可知,﹣NO2还原得到﹣NH2 , 由于苯胺易被氧化,所以用KMnO4(H+)先氧化﹣CH3成﹣COOH,再将﹣NO2还原得到﹣NH2 , 故A转化得到B是甲苯的硝化反应,可知A为
,反应中引入﹣COOH、﹣NH2 , 且处于邻位,甲基氧化得到﹣COOH,由题目信息可知,﹣NO2还原得到﹣NH2 , 由于苯胺易被氧化,所以用KMnO4(H+)先氧化﹣CH3成﹣COOH,再将﹣NO2还原得到﹣NH2 , 故A转化得到B是甲苯的硝化反应,可知A为 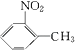 ,B为
,B为  ,
,  和
和 ![]() 发生取代反应生成C,由信息(1)可知生成C为
发生取代反应生成C,由信息(1)可知生成C为 ![]() ,据此进行解答.
,据此进行解答.


科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为2.5L的恒容密闭容器中发生反应:CO2(g)+H2S(g)COS(g)+H2O(g)
容器 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol | 平衡常数 | |
CO2 | H2S | H2O | |||
Ⅰ | 607 | 0.11 | 0.41 | 0.01 | / |
Ⅱ | 607 | 0.22 | 0.82 | / | |
Ⅲ | 620 | 0.1 | 0.4 | / | 6.74×10﹣3 |
下列说法正确的是( )
A.该反应正反应为放热反应
B.607K时该反应的平衡常数为2.50×10﹣3
C.容器Ⅱ达到平衡时容器中COS的物质的量为0.02mol
D.容器Ⅲ达平衡时,再充入少量氦气,平衡将向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某温度下,Ksp(AgCl)=1.56×10﹣10 , Ksp(Ag2CrO4)=1×10﹣12 . 下列关于该温度下的叙述正确的是( )
A.向氯化银的悬浊液中加入氯化钠溶液,Ksp(AgCl)减小
B.饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大
C.若向0.0008molL﹣1的K2CrO4溶液中加入等体积0.002 molL﹣1的AgNO3溶液,则CrO42﹣﹣完全沉淀
D.若将0.001molL﹣1AgNO3溶液滴入浓度均为0.001 molL﹣1的KCl和K2CrO4混合溶液中,则先产生AgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯化亚铜(一种难溶于水的白色固体)的流程如下:
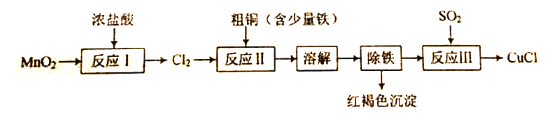
(1)“反应I”在加热条件下进行,同时有MnCl2生成,该反应的化学方程式为 __。
(2) “反应Ⅱ”中杂质与Cl2反应的化学方程式为__。 ⑶实验所用SO2气体可由铜和浓硫酸反应制得,该反应的化学方程式为__。
(4)“反应Ⅲ”的离子方程式为___。
(5)若将等物质的量的S02、Cl2通入水中,所得溶液几乎没有漂白性,该反应的离子方程式为___。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 2Fe+3Cl2
MnCl2+Cl2↑+2H2O 2Fe+3Cl2![]() 2FeCl3 Cu+2H2SO4 (浓)
2FeCl3 Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO
CuSO4+SO2↑+2H2O SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO![]() +4H+ Cl2+SO2+2H2O=4H++SO
+4H+ Cl2+SO2+2H2O=4H++SO![]() +2Cl-
+2Cl-
【解析】(1)MnO2与浓盐酸反应生成MnCl2和Cl2,Mn元素化合价由+4价降低为+2价,盐酸中Cl元素化合价降为0价,根据元素守恒,反应有水生成,可得MnO2+HCl(浓) —MnCl2+Cl2↑+H2O,根据化合价升降守恒配平方程式:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(2)粗铜中含有少量铁,通入Cl2,将Cu氧化为CuCl2,将Fe氧化为FeCl3,生成FeCl3的反应方程式为2Fe+3Cl2![]() 2FeCl3;
2FeCl3;
(3)铜和浓硫酸反应制SO2,反应方程式为Cu+2H2SO4 (浓) ![]() CuSO4+SO2↑+2H2O;
CuSO4+SO2↑+2H2O;
(4)将CuCl2、FeCl3固体溶解后,再将铁离子转化为红褐色的氢氧化铁沉淀,过滤除铁,得到溶液CuCl2。向溶液中通入SO2,生成目标产物CuCl,Cu元素化合价降低,被还原,则SO2被氧化为SO42-,离子方程式为SO2+2Cu2++2Cl-+2H2O=2CuCl↓+SO42-+4H+;
(5)若将等物质的量的SO2、Cl2通入水中,恰好完全反应生成硫酸和盐酸,所得溶液没有漂白性,离子方程式为Cl2+SO2+2H2O=4H++SO42-+2Cl-。
【题型】综合题
【结束】
23
【题目】有关物质的转化关系如下图所示(反应中部分物质已略去)。A、C、G、K、M 为单质,其中G、K、L、M 为气体,其中M能使带火星的木条复燃,D可用作耐高温材料,为黑色磁性氧化物, E为常见的强碱。
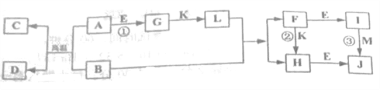
(1)D的化学式为__。
(2)写出反应①的离子方程式:__。
(3)写出反应②的离子方程式:__。
(4)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.等体积等物质的量浓度的氢氧化钡溶液与碳酸氢铵溶液混合:Ba2++2OH﹣+NH4++HCO3﹣=BaCO3↓+NH3H2O+H2O
B.氯化铝溶液中加入过量的氨水:Al3++4 NH3H2O=4NH4++AlO2﹣+2H2O
C.向次氯酸钙溶液中通入少量的二氧化硫:Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO
D.碳酸钠溶液中加入过量的苯酚: ![]() +CO32﹣=
+CO32﹣= ![]() +HCO3﹣
+HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应①X(g)+2Y(g)2Z(g)、②2M(g)N(g)+P(g)分别在密闭容器的两个反应室中进行,反应室之间有无摩擦,可滑动的密封隔板.反应开始和达到平衡状态时有关物理量的变化如图所示:下列判断正确的是( ) 
A.反应①的正反应是吸热反应
B.达平衡(Ⅰ)时体系的压强与反应开始时体系的压强之比为14:15
C.达平衡(Ⅰ)时,X的转化率为 ![]()
D.在平衡(Ⅰ)和平衡(Ⅱ)中,M的体积分数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,原子序数依次增大.其中A与E同主族,B的最外层电子数是次外层电子数的2倍,C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X.A、B、D、E可组成化合物A2D2、B2A2、E2D2 , 它们都含有非极性共价键.
(1)C元素在周期表中的位置是 , 写出B的最高价氧化物的电子式 .
(2)X的水溶液显(填“酸”、“碱”或“中”)性,理由是(用离子方程式表示) , 溶液中各种离子浓度由大到小的顺序为 .
(3)A、B、D、E四种元素组成的化合物中原子个数最少的化合物的化学式为 .
(4)火箭推进器中装有液态的C2A4和液态A2D2 , 它们发生化学反应时生成气态C单质和水蒸气,并放出大量的热.已知0.4mol液态C2A4跟液态A2D2完全反应时,放出256.6kJ热量,该反应的热化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com