
 碳及其化合物在研究和生产中有许多重要用途.请回答下列问题:
碳及其化合物在研究和生产中有许多重要用途.请回答下列问题: .
.| 碳酸盐 | MgCO3 | CaCO3 | BaCO3 | SrCO3 |
| 热分解温度/℃ | 402 | 900 | 1172 | 1360 |
| 阳离子半径/pm | 66 | 99 | 112 | 135 |
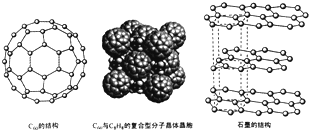
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60分析 (1)原子核外没有运动状态相同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规则画出价电子排布图;
(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,杂化轨道数目为3;
(3)分解本质是阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳,阳离子半径越小,其结合氧离子能力越强;
(4)根据均摊法计算晶胞中C60数目,立方烷分子填充在原C60晶体的分子间空隙中,根据晶胞中C60数目确定立方烷数目,进而确定化学式;
(5)由图可知石墨的晶胞结构为 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为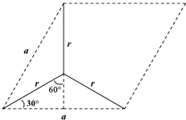 ,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,再计算底面面积,根据均摊法计算晶胞质量,结合ρ=$\frac{m}{{a}^{2}sin60°×2d}$计算.
,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,再计算底面面积,根据均摊法计算晶胞质量,结合ρ=$\frac{m}{{a}^{2}sin60°×2d}$计算.
解答 解:(1)碳原子核外有6个电子,原子核外没有运动状态相同的电子,即有6种运动状态不同的电子,碳原子价电子排布式为2s22p2,根据泡利原理与洪特规,价电子排布图为 ,
,
故答案为:6; ;
;
(2)光气的分子式为COCl2,其分子中C原子形成3个σ键,没有孤对电子,空间结构为平面三角形,杂化轨道数目为3,C原子采取sp2杂化,
故答案为:平面三角形;sp2;
(3)碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解,
故答案为:碳酸盐分解实际过程是晶体中阳离子结合碳酸根离子中氧离子,使碳酸根离子分解为二氧化碳的过程,阳离子所带电荷相同时,阳离子半径越小,其结合氧离子能力越强,对应的碳酸盐就越容易分解;
(4)晶胞中C60数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,立方烷分子填充在原C60晶体的分子间空隙中,晶胞中立方烷数目为4,则化学式为C8H8.C60,
故答案为:C8H8.C60;
(5)由图可知石墨的晶胞结构为 ,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为
,设晶胞的底边长为acm,晶胞的高为h cm,层间距为d cm,则h=2d,底面图为 ,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,则底面面积为($\sqrt{3}$r)2×Sin60°,晶胞中C原子数目为1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,晶胞质量为$\frac{4×12}{{N}_{A}}$g,则:
,则$\frac{a}{2}$=r×sin60°,可得a=$\sqrt{3}$r,则底面面积为($\sqrt{3}$r)2×Sin60°,晶胞中C原子数目为1+2×$\frac{1}{2}$+8×$\frac{1}{8}$+4×$\frac{1}{4}$=4,晶胞质量为$\frac{4×12}{{N}_{A}}$g,则:
ρg.cm-3=$\frac{4×12}{{N}_{A}}$g÷[($\sqrt{3}$r)2×Sin60°×2d]cm3,整理可得d=$\frac{\sqrt{3}}{16}$ρNAr2,
故答案为:4;$\frac{\sqrt{3}}{16}$ρNAr2.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、杂化方式判断、晶胞计算等,(3)注意对化学反应本质的理解,(5)中计算为易错点、难点,基本属于纯数学计算,需要学生具备一定的数学计算能力,难度较大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅能与氢氟酸反应,可用于制光导纤维 | |
| B. | 浓硫酸具有脱水性,可用于干燥氯气 | |
| C. | 漂白粉在空气中不稳定,可用于漂白纸张 | |
| D. | 氧化铝熔点很高,可用于制耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 g H218O与D2O的混合物中所含中子数为NA | |
| B. | 2.8gN2和CO的混合气体中所含质子数为1.4NA | |
| C. | 235g${\;}_{92}^{235}$U发生裂变反应${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n,净产生的中子(${\;}_{0}^{1}$n)数为9NA | |
| D. | 50mL12mol/L-1盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 成语、谚语、俗语 | 理解或寓意 |
| A | “甘之如饴” | 糖类均有甜味 |
| B | “冰、水为之,而寒于水” | 相同质量和温度的水和冰,冰的能量高 |
| C | “雷雨肥庄稼” | 农作物生长需要水,雷雨天提供了大量的雨水 |
| D | “春蚕到死丝方尽” | 蚕丝的只要成分是蛋白质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .1mol乙最多可与5molH2反应.
.1mol乙最多可与5molH2反应.
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠 | B. | 氢氧化铝 | C. | 碳酸镁 | D. | 硫酸钡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O在高温下难分解,H2S在300℃即分解,说明氧的非金属性比硫强 | |
| B. | I-的还原性比Br-强,由此可推断溴的非金属性比碘强 | |
| C. | H2CO3的酸性比HClO的酸性强,说明碳的非金属性比氯强 | |
| D. | 已知反应:2NH3+3Cl2═N2+6HCl,由此可推断非金属性氯强于氮 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 还原性 H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | M与T形成的化合物能与NaOH溶液反应 | |
| D. | L2+与R2-的核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com