
| A.原子半径D <C <B<A | B.原子序数 d > c > a > b |
| C.离子半径C>D>B> A | D.单质的氧化性C > D > A >B |
科目:高中化学 来源:不详 题型:单选题
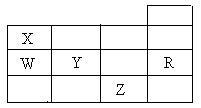
| A.通常情况下五种元素的单质中,Z单质的沸点最高 |
| B.Y、Z的阴离子电子层结构都与R原子的相同 |
| C.W的氢化物的沸点比X的氢化物的沸点高 |
| D.元素最高价氧化物对应的水化物的酸性Y比W强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | 相关信息 |
| X | X的基态原子L层电子数是K层电子数的2倍 |
| Y | Y的基态原子最外层电子排布式为:nsnnpn+2 |
| Z | Z存在质量数为23,中子数为12的核素 |
| W | W有多种化合价,其白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.19 | B.18 | C.27 | D.9 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| | IA | ⅡA | | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 | |
| 1 | a | | b | |||||||
| 2[ | | | | | c | d | e | f | g | |
| 3 | h | | i | j | | | k | l | ||
| 4 | m | | | | | ] | n | | ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com