
【题目】某学习小组利用下列装置进行进行CO2与饱和Na2CO3溶液反应制备NaHCO3实验.
(1)选取必要的实验装置,正确的连接顺序为(填序号).
(2)为确定制得的固体样品是纯净的NaHCO3 小组同学提出下列实验方案:甲方案:将样品溶液与饱和澄清石灰水反应,观察现象.
乙方案:将样品溶液与BaCl2观察现象.
丙方案:测定pH法
丁方案:热重分析法
①判定甲方案(填“可行”或“不可行”);
②为判断乙方案的可行性,某同学用分析纯的NaHCO3配制的溶液,与BaCl2溶液等体积混合进行实验,结果如下. 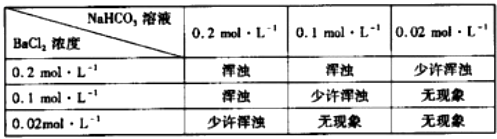
(i)此实验巳可说明乙方案是不可行的.请结合以下数据,并通过计算说明产生浑浊的原因.答: . [已知:0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , Ksp(BaCO3)=5.1×10﹣9]
(ⅱ)产生浑浊的离子方程式为 .
③使用pH计进行测定的丙方案是 .
④进行丁方案实验,测得样品在不同升温速率下的热重曲线如右图.请填空:
(i)样品的纯度为 .
(ⅱ)升温速率对实验结果(填“有较大”、“有较小”或“没有”)影响.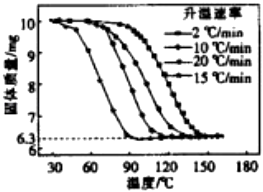
【答案】
(1)③①②
(2)不可行;Q=c(Ba2+)×c(CO32﹣)= ![]() ×0.0011=1.1×10﹣4>5.1×10﹣9;Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH;100%;没有
×0.0011=1.1×10﹣4>5.1×10﹣9;Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH;100%;没有
【解析】解:(1)③为发生装置,盐酸与碳酸钙反应生成二氧化碳气体和氯化钙,其中盐酸易挥发,故应先选取碳酸氢钠除去混合气体中的HCl,故仪器连接顺序为:③①②,所以答案是:③①②;(2)①饱和澄清石灰水与碳酸钠和碳酸氢钠均能反应生成碳酸钙沉淀,故甲方案不可行,所以答案是:不可行;②(i)两种溶液等体积混合后,溶液中钡离子浓度= ![]() =0.1mol/L,0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , 故Q=Q=c(Ba2+)×c(CO32﹣)=
=0.1mol/L,0.1 molL﹣1 NaHC03溶液电离出的c(CO32﹣)为0.0011 molL﹣1 , 故Q=Q=c(Ba2+)×c(CO32﹣)= ![]() ×0.0011=1.1×10﹣4>5.1×10﹣9 , 故会产生沉淀,所以答案是:Q=c(Ba2+)×c(CO32﹣)=
×0.0011=1.1×10﹣4>5.1×10﹣9 , 故会产生沉淀,所以答案是:Q=c(Ba2+)×c(CO32﹣)= ![]()
![]() ×0.0011=1.1×10﹣4>5.1×10﹣9;(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O,所以答案是:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;③丙方案为测定pH法,由于碳酸氢钠属于强碱弱酸盐,故利用准确度较高的pH计进行样品的pH值,然后测量分析纯NaHC03的pH值,最后比较即可,所以答案是:取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH;④(i)碳酸氢钠不稳定,加热易分解,方程式为2NaHCO3
×0.0011=1.1×10﹣4>5.1×10﹣9;(ii)钡离子与碳酸氢钠电离出的碳酸根结合生成碳酸钡沉淀,从而促进了碳酸氢根的电离,使其向生成碳酸根和氢离子的方向移动,故离子反应方程式为:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O,所以答案是:Ba2++2HCO3﹣=BaCO3↓+CO2↑+H2O;③丙方案为测定pH法,由于碳酸氢钠属于强碱弱酸盐,故利用准确度较高的pH计进行样品的pH值,然后测量分析纯NaHC03的pH值,最后比较即可,所以答案是:取等质量的固体样品和分析纯NaHC03样品分别溶解于等量的水中,分别用pH计测pH;④(i)碳酸氢钠不稳定,加热易分解,方程式为2NaHCO3 ![]() Na2CO3+H2O+CO2↑,即 2NaHCO3
Na2CO3+H2O+CO2↑,即 2NaHCO3 ![]() Na2CO3+H2O+CO2↑,
Na2CO3+H2O+CO2↑,
168 106
10g x,解x=6.30g,即理论上碳酸氢钠每有10g分解应生成6.3g固体,故由图可知10g样品分解恰好生成固体为6.3g,故此样品纯度为: ![]() ×100%=100%,所以答案是:100%;(ii)由图可知,温度升高,不影响固体物质的产量,升温速率对实验结果没有影响,所以答案是:没有.
×100%=100%,所以答案是:100%;(ii)由图可知,温度升高,不影响固体物质的产量,升温速率对实验结果没有影响,所以答案是:没有.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.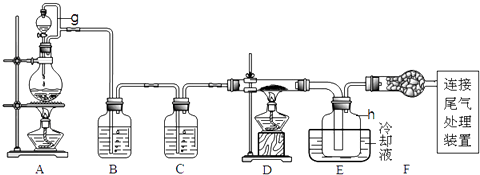
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 .
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是 .
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+ . ①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是 .
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10﹣2molL﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 . 若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2NO2 (红棕色)N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 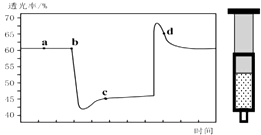
A.b点的操作是压缩注射器,平衡正向移动
B.c点与a点相比,c(NO2)增大,c(N2O4)减小
C.d 点:v(正)>v(逆)
D.若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A. SO2通入酸性KMnO4溶液,褪色:2MnO4-+4H++5SO22Mn2++5S +2H2O
B. 氯化铝溶液中加入过量氨水:Al3++4OH-AlO2+2H2O
C. NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3- +2OH-![]() NH3↑+SO32+2H2O
NH3↑+SO32+2H2O
D. 次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO-+H2O+CO2CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由以下五种不同基团两两结合而形成的化合物,能与NaOH溶液反应的共有( )
①﹣CH3②﹣OH③﹣C6H5④﹣CHO⑤﹣COOH.
A.6种
B.5种
C.4种
D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,正确的是( )
A.H2S2H++S2﹣
B.NaHCO3═Na++H++CO32﹣
C.NaCl═Na++Cl﹣
D.CH3COOH═CH3COO﹣+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)广泛分布于自然界,其原子结构示意图是 ![]() .
.
(1)砷位于元素周期表中族,其气态氢化物的稳定性比NH3(填“强”或“弱”).
(2)砷的常见氧化物有As2O3和As2O5 , 其中As2O5热稳定性差.根据图1写出As2O5分解为As2O3的热化学方程式: . 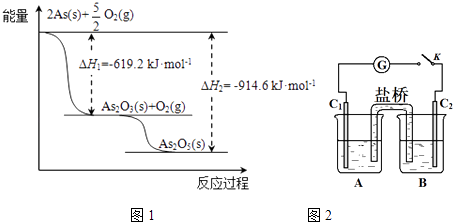
(3)砷酸盐可发生如下反应:AsO43﹣+2I﹣+2HAsO33﹣+I2+H2O.图2装置中,C1、C2是石墨电极
①A中盛有棕色的KI和I2的混合溶液,B中盛有无色的Na3AsO4和Na3AsO3的混合溶液,当连接开关K,并向B中滴加浓盐酸时发现灵敏电流计G的指针向右偏转.此时C2上发生的电极反应是 .
②一段时间后,当电流计指针回到中间“0”位时,再向B中滴加过量浓NaOH溶液,可观察到电流计指针(填“不动”、“向左偏”或“向右偏”).
(4)利用(3)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样溶于NaOH溶液,得到含AsO43﹣和AsO33﹣的混合溶液.
As2O5与NaOH溶液反应的离子方程式是 .
②上述混合液用0.02500molL﹣1的I2溶液滴定,消耗I2溶液20.00mL.滴定完毕后,使溶液呈酸性,加入过量的KI,析出的I2又用0.1000molL﹣1的Na2S2O3溶液滴定,消耗Na2S2O3溶液30.00mL.(已知2Na2S2O3+I2=Na2S4O6+2NaI)试样中As2O5的质量是 g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni﹣Cd)可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2 . 有关该电池的说法正确的是( )
A.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在含有NaCl、Na2CO3、NaOH的水溶液中,加入过量的稀盐酸,溶液中离子数目不变的是( )
A.Na+B.CO32-C.OH-D.Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com