




 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
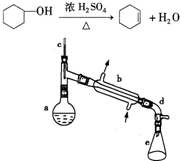 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g?cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 2Al3++3O2-
2Al3++3O2-查看答案和解析>>
科目:高中化学 来源: 题型:解答题
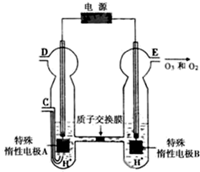 臭氧是一种强氧化剂,常用于消毒、灭菌等.
臭氧是一种强氧化剂,常用于消毒、灭菌等.| pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
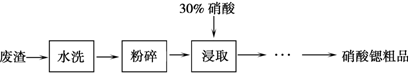
| 温度/℃物质 | 0 | 20 | 30 | 45 | 60 | 80 |
| Sr(NO3)2 | 28.2 | 40.7 | 47 | 47.2 | 48.3 | 49.2 |
| Ca(NO3)2?4H2O | 102 | 129 | 152 | 230 | 300 | 358 |
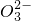 ═SrCO3↓ Ba2++C
═SrCO3↓ Ba2++C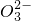 ═BaCO3↓
═BaCO3↓查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com