
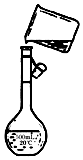
 某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
某同学用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:分析 (1)依据配制一定物质的量浓度溶液的一般步骤选择需要的仪器,依据配制溶液体积、“大而近”的原则选择容量瓶规格;
(2)依据m=CVM计算需要溶质的质量,依据配制一定物质的量浓度溶液的一般步骤判断缺少的步骤;
(3)依据移液操作应用玻璃棒引流,容量瓶规格应选择1000mL解答;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管,配制0.05mol/L的CuSO4溶液980mL,应选择1000mL容量瓶,所以还缺少的玻璃仪器:1000mL容量瓶、玻璃棒;
故答案为:1000mL容量瓶;玻璃棒;
(2)用胆矾晶体(CuSO4•5H2O)配制0.05mol/L的CuSO4溶液980mL,应选择1000mL容量瓶,实际配制1000mL溶液,需要胆矾的质量m=1L×0.05mol/L×250g/mol=12.5g;称量完固体药品后应先在烧杯中溶解再移液;
故答案为:12.5;溶解;
(3)该同学转移溶液的示意图,错误之处:未用玻璃棒引流;未使用1000 mL容量瓶;
故答案为:未用玻璃棒引流;未使用1000 mL容量瓶;
(4)①用托盘天平称量时砝码放在左盘,实际秤取质量为砝码质量减去游码质量,导致称取溶质的质量偏小,溶质的物质的量偏小,溶液浓度偏低,故选;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,导致部分溶质损耗,溶质的物质的量偏小,溶液浓度偏低,故选;
③定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故不选;
④定容时仰视刻度线,导致溶液体积偏大,溶液浓度偏低,故选;
⑤干净的容量瓶未经干燥就用于配制溶液,对溶质的物质的量和溶液体积都不产生影响溶液浓度不变,故不选;
故选:①②④.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意容量瓶规格选择及误差分析的方法.


科目:高中化学 来源: 题型:选择题
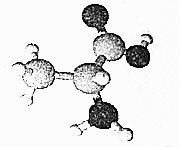
| A. | 常温常压下呈气态 | |
| B. | 分子式为C3H8O2N | |
| C. | 与H2NCH2COOH互为同系物 | |
| D. | 分子中所有C、N原子均处于同一平面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 199F- | B. | 1910Ne | C. | 2910F | D. | 2919K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2反应生成水 | B. | 锌片投入稀硫酸中生成H2 | ||
| C. | H2O2分解制取O2 | D. | NH3遇到HCl气体生成白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3的电离方程式:CaCO3═Ca2+CO32- | |
| B. | NaHS水解:HS-+H2O═H3O++S2- | |
| C. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| D. | 用少量氨水吸收工业尾气中的SO2:2NH3•H2O+SO2═2NH4++SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制2.0 mol•L-1的Na2CO3溶液950 mL,配制时应选用容量瓶的规格和称取Na2CO3固体的质量分别为950 mL和201.4 g | |
| B. | 标准状况下,用3.36L HCl气体做喷泉实验完毕后,液体冲入烧瓶的一半(假设实验过程溶液无泄漏),溶液中溶质的物质的量浓度为$\frac{1}{22.4}$mol/L | |
| C. | 向0.1mol•L-1 CH3COOH溶液中加入少量水,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$减小 | |
| D. | 将溶质相同质量分数分别为3p%的溶液和p%的溶液等体积混合得到质量分数为q%的溶液,则p、q的关系不可能为q>2p |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
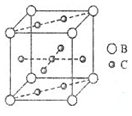 A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q
A、B、C、D、E、F六种元素,A、B、C属于第四周期元素且单质均为固体,原子处于基态时A、B原子核外电子均成对,且核电荷数A>B;C与A在周期表属于同一区的元素,如图是金属B和C所形成的某种合金的晶胞结构示意图;D、E、F均位于p区,D原子在基态时p轨道半充满且电负性是同族元素中最大的;E、F的原子均有三个能层,E原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;E与F能形成原子数目比为1:3、熔点为190℃的化合物Q .
.| 共价键 | C-C | C-N | C-S |
| 键能/kJ•mol-1 | 347 | 305 | 259 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 离子方程式 | |
| A | NH4+、Fe2+、SO42- | 少量Ba(OH)2溶液 | SO42-+2NH4++Ba2++2OH-=BaSO4↓+2NH3•5H2O |
| B | Mg2+、HCO3-、Cl-、 | 过量NaOH溶液 | Mg2++2HCO3-+4OH-=2H2O+Mg(OH)2↓+2CO32- |
| C | K+、NH3•H2O、CO32- | 通入少量CO2 | 2OH-+CO2=CO32-+H2O |
| D | Fe3+、NO3-、HSO3- | NaHSO4溶液 | HSO3-+H+=SO2↑+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 mol•L-1 的Na2SO4溶液中含有4 NA个Na+ | |
| B. | 将含有0.1 mol FeCl3的饱和溶液逐滴滴入足量沸水中,得到Fe(OH)3胶体数目为0.1 NA | |
| C. | 在标准状况下,11.2 L氖气中含有NA个氖原子 | |
| D. | 7.8 g Na2O2中阴离子数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com