
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如图所示。
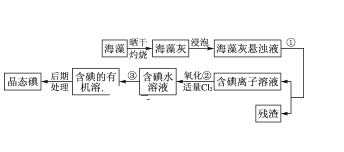
(1)指出提取碘的过程中有关的实验操作名称___、___。
(2)写出流程图中氧化②的离子反应议程式___。
(3)提取碘的过程中,可供选择的有机试剂是___。
A.酒精 B.四氯化碳 C.醋酸 D.水
(4)为使海藻灰中碘离子转化为碘的有机溶液,实验室里有烧杯、玻璃棒、集气瓶、酒精灯、导管、圆底烧瓶、石棉网以及必要的夹持仪器,尚缺少的玻璃仪器是___。
(5)从含碘的有机溶液中提取碘和回收有机溶剂,还需经过蒸馏,指出图中实验装置中的错误之处。
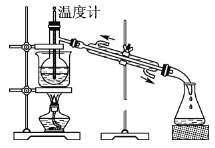
①____;
②____;
③____。
【答案】过滤 萃取 2I-+Cl2═2Cl-+I2 B 分液漏斗和漏斗 加热未垫石棉网 温度计的位置不正确 冷凝管进出水方向不正确
【解析】
海带晒干灼烧可生成水和二氧化碳,海带灰中含有碘化钾等物质溶于水,浸泡过滤得到含有碘离子的溶液,加入氯水或通入氯气,氯气置换出碘,得到碘的水溶液,用四氯化碳萃取得到含碘的有机溶液,经蒸馏可得到碘,,以此解答该题。
(1)①分离固体和液体用过滤,利用溶质在互不相溶的溶剂里溶解度不同,用一种溶剂把溶质从它跟另一种溶剂所组成的溶液里提取出来,这种方法叫做萃取;③利用有机物将碘水中的碘单质萃取出来,互不相溶的物质的分离是分液法;
(2)过程②中的反应是氯气氧化碘离子生成碘单质,反应的离子方程式为: 2I-+Cl2═2Cl-+I2
(3)萃取的基本原则两种溶剂互不相溶,且溶质在一种溶剂中的溶解度比在另一种大的多,故可用四氯化碳,因此,本题正确答案是:B;
(4)为使海藻灰中碘离子转化为碘的有机溶液,根据实验装置原理,基本操作有过滤、萃取分液、使用的仪器有:烧杯、玻璃棒、漏斗,分液漏斗等,尚缺少的玻璃仪器是(普通)漏斗和分液漏斗;
(5)冷凝水应是下进上出,烧杯加热应垫石棉网,温度计水银球应与烧瓶支管口相平。


科目:高中化学 来源: 题型:
【题目】过氧乙酸是一种绿色生态杀菌剂,结构简式为 ,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
,可用乙酸与过氧化氢一定条件下反应制得。下列说法不正确的是( )
A.过氧化氢的电子式![]()
B.乙酸溶于水:CH3COOH=CH3COO-+H+
C.过氧乙酸中含有极性共价键和非极性共价键
D.制备过氧乙酸的化学反应方程式:CH3COOH+H2O2![]() CH3COOOH+H2O
CH3COOOH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一些行业的废水中氨氮含量严重超标,废水脱氮已成为主要污染物减排和水体富营养化防治的研究热点,有多种方法可以去除。
I.电镀行业废水处理流程如图:
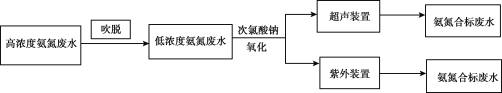
(1)吹脱法除氨氮:水中的氨氮大多数以NH4+和游离态的NH3保持平衡状态而存在。将空气直接通入水中,使气相和液相充分接触。水中溶解的游离氨穿过气液界面,向气相转移。从而达到脱除氨的目的。氨氮废水中NH3和NH4+平衡态的平衡关系有___。
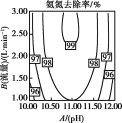
(2)温度、pH值、空气流量对脱除氨有很大的影响。pH值、空气流量对脱除氨影响如图所示。由图可以看出,空气流量一定时,10<pH<11时,吹脱率随着pH增加而增加,请用化学平衡移动原理解释原因___。
(3)次氯酸钠氧化法:利用次氯酸钠氧化废水中氨氮的离子方程式是___。
II.对于含有H2PO4-的氨氮废水还可以用电化学沉淀与阴极氧化协同去除水中的氨氮,装置如图所示。电解过程中,石墨毡电极产生OH-,在通入O2的情况,又产生H2O2,以氧化水中的NH4+,同时NH4+还可以通过生成MgNH4PO46H2O沉淀而持续被除去。
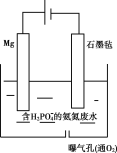
(1)阳极的电极反应式是___。
(2)废水中的NH4+'转化为MgNH4PO46H2O的离子方程式是___。
(3)pH大于10.5不利于MgNH4PO46H2O的生成,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用LiOH和钴氧化物可制备锂离子电池正极材料。可用电解LiCl溶液制备LiOH,装置如图所示。下列说法正确的是
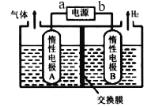
A.惰性电极B是阳极
B.电流流向为a→A→B→b
C.该电解池用的交换膜是阴离子交换膜
D.阳极发生的电极反应方程式:4OH- - 4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有两个相同带活塞的容器,向容器a中充入NO2(g)待颜色不再变化,再向容器b中充入溴蒸汽,使两容器的颜色和体积相等〔注意:同浓度的NO2和Br2蒸汽颜色相同,2NO2(g)![]() N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
N2O4(g)(无色),迅速将两容器同时压缩(假设气体不液化),下列说法正确的是
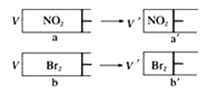
A.a→a′过程中,颜色突然加深,然后逐渐变浅,最终颜色比原来的浅
B.若对a和b以极慢的速度缓缓压缩,则a和b的颜色均慢慢加深,但在每一个相同的时间点,b的颜色总比a的深
C.假设容器和活塞均为无色,从容器左侧观察a和a′,a′的颜色比a浅
D.气体的物质的量:na一定大于nb′
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl、MgCl2、CaCl2组成的混合液中,部分离子浓度大小如图所示,回答下列问题
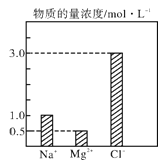
(1)该混合液中,NaCl的物质的量为_________mol,含溶质MgCl2的质量为_______g。
(2)该混合液中CaCl2的物质的量为___________mol,将该混合液加水稀释至体积为1 L,稀释后溶液中Ca2+的物质的量浓度为__________mol·L-1。
(3)向该稀释后的溶液中加入足量硝酸酸化的硝酸银溶液,可得到沉淀________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应FeO(s)+CO(g) Fe(s)+CO2(g),700 ℃时平衡常数为0.68,900℃时平衡常数为0.46。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为:![]()
C. 增大CO2浓度,平衡常数增大
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缺电子化合物是指电子数不符合路易斯结构(一个原子通过共享电子使其价层电子数达到8,H原子达到2所形成的稳定分子结构)要求的一类化合物。下列说法错误的是
A.NH3、BF3、BF4-中只有BF3是缺电子化合物
B.BF3、BF4-中心原子的杂化方式分别为sp2、sp3
C.BF3与NH3反应时有配位键生成
D.BF4-的键角小于NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎的成因是在关节滑液中形成尿酸钠晶体——NaUr,其平衡关系为:Ur—(aq)+Na+(aq) ![]() NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
NaUr(s),其中Ur—表示尿酸根离子。医生常嘱咐关节炎病人要注意保暖,特别是手脚等离心脏较远的部位。因为第一次关节炎的发作大都在手指或脚趾的关节处。这说明
A. 形成尿酸钠晶体的反应为放热反应 B. 形成尿酸钠晶体的反应为吸热反应
C. 尿酸钠溶解度较大 D. 尿酸钠晶体一定难溶于水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com