
| 元素代号 | Q | R | X | Z | ||
| 微粒信息 | 离子: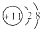 | 单质分子:R2 | 离子:X3+ | 一种原子:
|
 可知Q的质子数为11,为Na元素;816Z的质子数为8,则Z为O元素;Q、R、X在同一周期,且X为+3价,则X为Al元素;R2常温常压下为气体,R为Cl元素,然后结合元素的性质及化学用语来解答.
可知Q的质子数为11,为Na元素;816Z的质子数为8,则Z为O元素;Q、R、X在同一周期,且X为+3价,则X为Al元素;R2常温常压下为气体,R为Cl元素,然后结合元素的性质及化学用语来解答.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
| A、蒸馏法是除去水中杂质得到纯净的水的最好方法 |
| B、用过滤的方法除去NaCl溶液中含有的少量淀粉胶体 |
| C、用溶解、过滤的方法提纯含有少量BaSO4的BaCO3 |
| D、用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2等杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:
 如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:
如图在下衬白纸的玻璃片中央放置适量的KMnO4颗粒,在周围分别滴加一滴KBr溶液,品红溶液,含有酚酞的澄清石灰水,FeC12溶液,然后在KMnO4晶体上滴加适量的浓盐酸,迅速盖好表面皿.提示:实验室中所用的少量氯气可以用下述原理制取:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量浓度相等的溶液pH关系:pH(NaClO)>pH(Na2CO3)>pH(CH3COONa) |
| B、向NaClO溶液中通少量CO2:CO2+NaClO+H2O→NaHCO3+HClO |
| C、a mol/L HClO与b mol/L NaOH溶液等体积混合后所得溶液中c(Na+)>c(ClO-),则a一定小于b |
| D、向氯水中加入NaHCO3固体,可以增大氯水中次氯酸的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+和Cl-在水溶液中混合,其反应的活化能接近于零 |
| B、活化能的大小对化学反应前后的能量变化能产生影响 |
| C、加催化剂能降低正反应的活化能,但不降低逆反应的活化能 |
| D、温度降低,反应速率减慢,其原因是降低了反应的活化能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、使甲基橙变红色的溶液中:NO3-、SO42-、Fe2+、Na+ |
| B、澄清透明的溶液中:ClO-、MnO4-、Al3+、SO42- |
| C、澄清透明的溶液中:MnO4-、Al3+、SO42-、K+ |
| D、水电离产生c(H+)=1×10-12mol/L的溶液中,Mg2+、Na+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com