
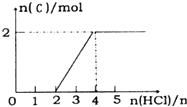
| A. | 1molCH5+与1molNH2-所含电子数均为10NA | |
| B. | 60gSiO2晶体中所含[SiO4]四面体数为0.5NA | |
| C. | 25℃,pH=10的Na2CO3溶液中所含OH-数为1×10-4NA | |
| D. | 标准状况下,22.4LCO、NO混合气体中所含氧原子数为2NA |
分析 A.每个CH5+、NH2-中都含有10个电子;
B.n(SiO2)=$\frac{60g}{60g/mol}$=1mol,每个Si原子和四个O原子形成四面体结构;
C.25℃,pH=10的Na2CO3溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=1×10-4mol/L,但溶液体积未知;
D.标况下,22.4LCO、NO混合气体的物质的量为1mol,混合气体的分子数为NA,每个CO、NO中都含有1个O原子,结合分子构成计算O原子个数.
解答 解:A.每个CH5+、NH2-中都含有10个电子,所以1molCH5+与1molNH2-所含电子数均为10NA,故A正确;
B.n(SiO2)=$\frac{60g}{60g/mol}$=1mol,每个Si原子和四个O原子形成四面体结构,所以60gSiO2晶体中Si原子个数为NA,所含[SiO4]四面体数为NA,故B错误;
C.25℃,pH=10的Na2CO3溶液中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-10}}$mol/L=1×10-4mol/L,但溶液体积未知导致无法计算OH-个数,故C错误;
D.标况下,22.4LCO、NO混合气体的物质的量为1mol,混合气体的分子数为NA,每个CO、NO中都含有1个O原子,结合分子构成得O原子个数为NA,故D错误;
故选A.
点评 本题以阿伏伽德罗常数为载体考查物质的量有关计算,为高频考点,明确物质构成微粒及离子中电子数计算方法是解本题关键,侧重考查学生分析判断及计算能力,易错选项是D,题目难度不大.


科目:高中化学 来源: 题型:解答题
 A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题:
A、B、C、D、E 分别代表中学化学中的常见物质,请根据题目要求回答下列问题: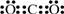 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
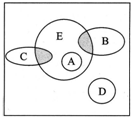 如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.
如图方框内区域表示所有的化学反应,大圈内区域表示氧化还原反应,大圈外区域表示非氧化还原反应,其中A~D分别表示4种基本反应类型.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由碳燃烧生成CO的热化学方程式是C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=(Q1-0.5Q2)kJ/mol | |
| B. | 由碳燃烧生成1mol CO放出的热量是(Q1-0.5Q2)kJ | |
| C. | 由碳燃烧生成CO的热化学方程式是2C(s)+O2(g)═2CO(g)△H=(Q2-2Q1)kJ/mol | |
| D. | 碳和CO2反应的热化学方程式是C(s)+CO2(g)═2CO(g)△H=(2Q2-2Q1)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
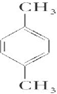 ;
;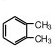 ;
;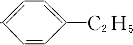 、
、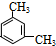 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合气体中一定有甲烷 | B. | 混合气体可能是甲烷和乙烯 | ||
| C. | 混合气体中一定有乙烷 | D. | 混合气体可能是乙烯和乙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
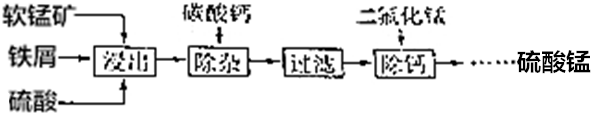
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ① | |||||||||||||||||
| ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||||||||||
| ⑨ | ⑩ |
 ;
;| 晶体Ⅰ | 晶体Ⅱ | |
| 熔点/K | 1840 | 2803 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com