
| A. | 过滤 | B. | 结晶 | C. | 蒸馏 | D. | 升华 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题

| A. | M的相对分子质量是180 | |
| B. | M与足量的NaOH溶液发生反应时,所得的有机产物的化学式C9H4O5Na4 | |
| C. | 1molM最多能与2molBr2发生反应 | |
| D. | 1molM与足量NaHCO3反应能生成2molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 族 | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ⑩ | ⑪ | ⑫ |
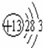 ;⑪
;⑪ .
. ;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).
;在一定条件下,若将元素①的单质和氢气的混合气体通入4L的密闭容器中发生反应,半分钟后测得生成物的物质的量为1.4mol,则用元素①的单质表示的反应速率为0.35mol/(L•min).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子晶体都是单质 | |
| B. | 分子晶体在常温下不可能为固态 | |
| C. | 非金属元素的气态氢化物越稳定,其氧化物对应的水化物酸性越强 | |
| D. | 非金属元素的气态氢化物相对分子质量越大,熔沸点不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子半径:A>B>C>D | B. | 原子序数:b>a>c>d | ||
| C. | 金属性:B>A,非金属性:D>C | D. | 离子半径:D>C>A>B |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等 | |
| B. | 中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒 | |
| C. | 用碱式滴定管量取0.10 mol•L-1的Na2CO3溶液22.10 mL | |
| D. | 用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Br2在反应中表现氧化性 | B. | SO2在反应中被还原 | ||
| C. | Br2在反应中得电子 | D. | 1mol氧化剂在反应中得到1mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com