
【题目】甲、乙两种固体纯净物的溶解度曲线如图所示。在常温下,先在两支试管里分别装入甲、乙两种物质的饱和溶液(试管底部均有未溶解的固体),再放进盛有冰水的烧杯里。下列说法正确的是( )


A. 乙溶液中溶质的质量分数增大
B. 装甲溶液的试管中剩余的固体减少
C. 试管里甲、乙物质的溶解度都增大
D. 两支试管里剩余的固体都增多
【答案】A
【解析】
常温下物质的饱和溶液(试管底部均有未溶解的固体)放进盛有冰水的烧杯里,目的是对饱和溶液进行降温;根据溶解度曲线得知,甲物质的溶解度随温度降低而减小,乙物质的溶解度随温度降低而增大,据此分析解答。
A.乙物质的溶解度随温度降低变大,所以放入冰水后,随温度降低,试管底部固体物质乙继续溶解,溶液中溶质质量增加,所以乙溶液中溶质的质量分数增大,故A正确;
B.根据甲物质的溶解度曲线,温度降低,甲物质的溶解度减小,所以,放入冰水后,随温度降低,试管内饱和溶液析出晶体,剩余固体物质甲增加,故B错误;
C.固体物质的溶解度受温度影响,根据溶解度曲线,甲物质的溶解度随温度降低而减小,乙物质的溶解度随温度降低而增大,故C错误;
D.综合A、B两项的分析,盛甲物质的试管内固体物质增加,盛乙物质的试管内固体物质减少,故D错误;
故选A。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】认真分析物质的量浓度的概念及其定义式并思考,下列溶液中溶质的物质的量浓度为1mol·L-1的是( )
A. 将40gNaOH溶解于1L水中
B. 将22.4L氯化氢气体溶于水配成1L溶液
C. 将1L10 mol·L-1的浓盐酸与9L水混合
D. 将10gNaOH溶解于水中配成250mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11。若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是
A. 1∶9 B. 1∶1 C. 1∶2 D. 1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图所示。

①若“重整系统”发生的反应中n(FeO)/n(CO2)=6,则FexOy的化学式为____________。
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为________。
(2)工业上用CO2和H2反应合成二甲醚。已知:CO2(g)+ 3H2(g)═CH3OH(g)+ H2O(g) △H1=-53.7kJ/mol,CH3OCH3(g)+H2O(g) ═ 2CH3OH(g) △H2=+23.4kJ/mol,则2CO2(g)+ 6H2(g)![]() CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
CH3OCH3(g)+3H2O(g) △H3=______kJ/mol。
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____(填代号)。
a.逆反应速率先增大后减小 b.H2的转化率增大
c.反应物的体积百分含量减小 d.容器中的nCO2/nH2值变小
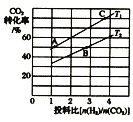
②在某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。T1温度下,将6 mol CO2和12molH2充入2L的密闭容器中,5 min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3) =___;KA、KB、KC三者之间的大小关系为_____。
(3)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在NH4HCO3溶液中:c (NH4+)_____c(HCO3-)(填“>”、“<”或“=”);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
NH3·H2O+H2CO3的平衡常数K=__________________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7mol·L-1,K2=4×10-11mol·L-1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把500mL含有BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol 硫酸钠的溶液恰好使钡离子完全沉淀;另取一份加入含b mol 硝酸银的溶液恰好使氯离子完全沉淀.则该混合溶液中钾离子浓度为( )
A. 0.1(b-2a)mol/LB. 10(2a-b)mol/LC. 10(b-a)mol/LD. 10(b-2a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知断开1molH-H键吸收的能量为436KJ,形成1molH-N键放出的能量为391KJ,根据化学方程式N2+3H2![]() 2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
2NH3,反应完1molN2放出的能量为924KJ,则断开1molN≡N键吸收的能量是
A.431KJ B.649KJ C.869KJ D.945.6KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度中,将1 molA 和2mol B放入容积为5L 的某密闭容器中发生反应:A(s) +2B(g)![]() C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
C(g)+2D(g)。5min后达到平衡,测得容器内B的浓度减少了0.2mol/L,则下列叙述不正确的是
A. 在5min 内该反应用C 的浓度变化表示的反应速率为0.02mol/(L·min)
B. 平衡时B 的转化率为50%
C. 平衡时B 的体积分数约为33.3%
D. 初始时的压强与平衡时的压强比为4 :5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】比较填空(填“>”、“<”或“=”)
(1)Ⅰ.比较等体积等浓度的溶液①盐酸 ②醋酸 与足量锌粒反应产生氢气的体积,① ②
Ⅱ.比较2H2(g)+O2(g)![]() 2H2O(g) ΔH 1 2H2(g)+O2(g)
2H2O(g) ΔH 1 2H2(g)+O2(g)![]() 2H2O(l) ΔH2的反应热 ΔH1 ΔH2
2H2O(l) ΔH2的反应热 ΔH1 ΔH2
Ⅲ.比较常温下两溶液水的电离程度,①pH=4盐酸 ②pH =10氨水溶液① ②
Ⅳ.同温度下溶液①使甲基橙呈现红色,溶液②使石蕊呈现紫色,比较两者pH① ②
(2)Ⅴ.已知某可逆反应aA(g) + bB(g) ![]() cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d
cC(g) + dD(g)。反应过程中,当其它条件不变时,C的体积分数与温度(T)和压强(P)的关系如右图,则a + b c + d

Ⅵ.比较①0.1mol/L醋酸与②0.01mol/L醋酸的导电能力,① ②
Ⅶ.1mol/L氨水与0.1mol/L氨水的c(OH-)之比 10
Ⅷ.体积相同的恒容密闭容器,在A中充入SO2和O2各1g,在B中充入SO2和O2各2g,相同条件下发生反应2SO2+O2![]() 2SO3 平衡时 SO2的转化率A B
2SO3 平衡时 SO2的转化率A B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再改变时,表明反应:A(s)+2B(g) ![]() C(g)+D(g) 已达平衡标志的是
C(g)+D(g) 已达平衡标志的是
A. 混合气体的压强 B. 混合气体的密度
C. B物质的分子量 D. 气体的总物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com