
下列有关化学用语表示正确的是
A.甲酸甲酯的结构简式:CH2O
B.Na+的结构示意图: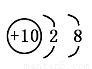
C.质子数为53、中子数为78的碘原子:13153I
D.CO2的电子式: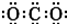
 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 都是银白色的柔软金属(除铯外) | |
| B. | 密度都比较小 | |
| C. | 碱金属单质都与水剧烈反应 | |
| D. | 单质的熔、沸点随原子序数的增加而升高 |
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期期中化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.对烃基苯甲醛的结构简式:
B.质量数为37的氯原子:1737Cl
C.NH4Br的电子式:
D.二氧化碳分子的比例模型:
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
工业上曾经通过反应“3Fe+4NaOH Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑十4Na↑;”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源:2017届江苏省高三上学期月考一化学试卷(解析版) 题型:选择题
化学在绿色发展、循环发展、低碳发展及推进生态文明建设中正发挥着积极作用,一卜列做法与可持续发展宗旨相违背的是
A.加大清洁能源的开发利用,提高资源的利用率
B.推广碳捕集和储存技术,逐步实现二氧化碳零排放
C.加大铅酸蓄电池、含汞锌锰干电池的生产,满足消费需求
D.对工业废水、生活污水净化处理,减少污染物的排放
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上期中化学试卷(解析版) 题型:选择题
设nA为阿伏加德罗常数的数值,下列说法正确的是
A.常温常压下,8 g O2含有4nA个电子
B.1 L 0.1 mol·L-1的氨水中有nA个NH
C.标准状况下,22.4 L盐酸含有nA个HCl分子
D.1 mol Na被完全氧化生成Na2O2,失去2nA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com