
| A. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 | |
| B. | 燃料电池中燃料都在负极发生氧化反应 | |
| C. | Fe3O4俗称铁红,常作红色油漆和涂料 | |
| D. | 工业上通常用电解Na、Mg、Al对应的氯化物制取该三种金属单质 |
分析 A.碳纤维属于无机非金属材料;
B.燃料电池的燃料都在负极,化合价升高,失去电子,发生氧化反应;
C.Fe2O3俗称铁红,常做红色油漆和涂料;
D.工业上通常用电解Al对应的氧化物制取该金属单质.
解答 解:A.碳纤维是由有机纤维经碳化及石墨化处理而得到的微晶石墨材料,不属于新型有机高分子材料,故A错误;
B.燃料电池中反应的实质是燃料与氧气的燃烧反应,燃料在负极发生氧化反应,故B正确;
C.Fe3O4为黑色晶体,Fe2O3俗称铁红,常作红色油漆和涂料,故C错误;
D.Al的制取不能用电解氯化铝的方法,因为氯化铝是共价化合物,熔融状态下不导电,故D错误;
故选B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定为a+2 | |
| B. | Y离子的结构示意图可表示为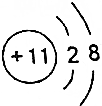 | |
| C. | 若b-a=6.则X和Y形成的化合物一定为离子化合物 | |
| D. | X有可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层电子数:E>F | |
| B. | 等物质的量的E和F分别与足量稀盐酸反应,产生氢气的物质的量:E>F | |
| C. | Ea+和Fb+有相同的电子层结构(a<b) | |
| D. | 25℃时,Ksp[E(OH)a]>Ksp[F(OH)b] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
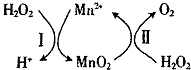 锰的化合物是优良的催化剂,可用于干电池原料生产等.
锰的化合物是优良的催化剂,可用于干电池原料生产等.| t/min | 0 | 2 | 4 | 6 |
| V(O2)mL | 0 | 9.9 | 17.2 | 22.4 |
| 反应 | 平衡常数KP | |
| 773K | 873K | |
| Ⅰ.CO2(g)+4H2(g)?CH4(g)+2H2(g) | 19.4 | 0.803 |
| Ⅱ.CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | 6.07×10-9 | 3.65×10-9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
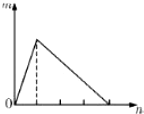 将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )
将溶液(或气体)X逐渐加入(或通入)到一定量Y溶液中,产生沉淀的量m与加入X的物质的量n的关系如图所示,符合图中情况的一组物质是( )| A | B | C | D | |
| X | Ba(OH)2 | NaOH | NH3 | HCl |
| Y | 明矾 | AlCl3 | MgSO4 | NaAlO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的溶液中:K+、Ba2+、Cl-、Br- | |
| B. | 含有0.1mol•L-1Fe3+的溶液中:K+、Mg2+、I-、SO42- | |
| C. | 含有0.1mol•L-1NO3-的溶液中:Na+、H+、SO42-、Fe2+ | |
| D. | 含有大量AlO2-的溶液中:NH4+、NO3-、Cl-、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,22gCO2含碳氧双键数目为2NA | |
| B. | 12.0gNaHSO4固体中含阳离子数为0.1NA | |
| C. | 标准状况下,22.4LBr2中所含分子数为NA | |
| D. | 7.8gNa2O2与足量的水反应转移电子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 氧化铝与盐酸:O2-+2H+═H2O | |
| C. | NaOH溶液与小苏打溶液反应:HCO3-+OH-═CO32-+H2O | |
| D. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com