
(14分)
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
1 | 27.83 | 25.00 |
2 | 26.53 | 25.00 |
3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A.KBr B.KI C.K2S D.K2CrO4
(1)① > ② 9.9×10-7
(2)<
(3)<7
(4)①0.1149;② A C
(5)D
【解析】
试题分析:(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,可知MOH为弱碱,混合溶液为强酸弱碱盐MCl水解呈酸性,促进水的电离,而HCl抑制水的电离,故混合溶液中由水电离出的c(H+)>0.2mol/LHCl溶液中由水电离出的c(H+);由电荷守恒:c(H+)+c(M+)= c(Cl—)+c(OH-)可知:c(Cl-)-c(M+)= c(H+)- c(OH-)=10-6-10-8= 9.9×10-7 mol/L(2)将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,所得溶液为MOH与MCl 1:1的混合液,混合溶液的pH<7说明溶液呈酸性即MOH的电离程度< MCl的水解程度;(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则HR为弱酸,故反应后溶液为NaR与大量的HR的混合液,溶液呈酸性,pH<7;(4)0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液重复三次的实验数据,可知第二组数据错误不可用,故 ,酸式滴定管未用标准液润洗,则标准液会被稀释,则消耗的V(标准)偏大,根据
,酸式滴定管未用标准液润洗,则标准液会被稀释,则消耗的V(标准)偏大,根据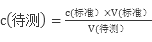 可知会导致测得c(NaOH)偏高;锥形瓶不用润洗,故没有润洗对实验结果无影响;滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了,会导致V(标准)偏大,故则会导致c(NaOH)偏高;滴定前,滴定管中的溶液液面最低点在“0”点以下,对实验结果无影响,消耗标准酸体积为滴定前后两次读数差值,故对结果无影响,故会导致偏高的为A、C;(5),沉淀滴定所用的指示剂本身就是一种沉淀剂,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定,则选用指示剂应①能与Ag+产生有颜色的沉淀,②该沉淀的Ksp应大于或等于AgCl 的Ksp,故可选用D. K2CrO4。
可知会导致测得c(NaOH)偏高;锥形瓶不用润洗,故没有润洗对实验结果无影响;滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了,会导致V(标准)偏大,故则会导致c(NaOH)偏高;滴定前,滴定管中的溶液液面最低点在“0”点以下,对实验结果无影响,消耗标准酸体积为滴定前后两次读数差值,故对结果无影响,故会导致偏高的为A、C;(5),沉淀滴定所用的指示剂本身就是一种沉淀剂,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定,则选用指示剂应①能与Ag+产生有颜色的沉淀,②该沉淀的Ksp应大于或等于AgCl 的Ksp,故可选用D. K2CrO4。
考点:滴定实验考查。


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源:2014-2015学年内蒙古巴彦淖尔市高二上学期期中化学试卷(解析版) 题型:选择题
对于达到平衡状态的可逆反应:N2+3H2 2NH3 (正反应为放热反应)下列叙述中正确的是
2NH3 (正反应为放热反应)下列叙述中正确的是
A.反应物和生成物的浓度相等
B.反应物和生成物的浓度不再发生变化
C.降低温度,平衡混合物里氨气的浓度减小
D.增大压强,不利于氨的合成
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高一上学期期末化学试卷(解析版) 题型:实验题
(15分)某小组为了探究“铁与水蒸气”能否发生反应及反应的产物,进行了系列实验。
(1)用下图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。

反应一段时间,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当 时(填实验现象),说明“铁与水蒸气”能够进行反应。写出铁与水蒸气反应的化学方程式 。
(2)为了证明反应后的固体混合物中含有+3价的Fe,他们计划取出少量混合物于试管中,加入足量的盐酸,溶解,过滤。写出有关的化学方程式:
(3)向滤液中滴加KSCN溶液,观察到溶液的颜色有两种可能,如下表。在下表中填写与现象相对应的结论与解释(可以不填满)。
现象 | 结论与解释 | |
可能① | 溶液由浅绿色变红色 | |
可能② | 溶液仍然为浅绿色 |
(4)可能①中,若要使红色又变成浅绿色,又不增加其它的金属离子,可以加入 ,可能②中,加入 可以使溶液变成红色。
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高一上学期期末化学试卷(解析版) 题型:选择题
将一块银白色的金属钠放在空气中会发生一系列的变化:表面迅速变暗→ “出汗” → 变成白色固体(粉末),(银白色→变暗→表面变潮→结块→变成粉末)。下列有关叙述中正确的是
A.表面迅速变暗是因为钠与空气中的氧气反应生成了过氧化钠
B.“出汗”是因为生成的氢氧化钠吸收空气中的CO2在表面形成了溶液
C.最后变成碳酸钠粉末
D.该过程中的所有化学反应均为氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高一上学期期末化学试卷(解析版) 题型:选择题
在1 L 1 mol·L-1的氨水中,下列说法正确的是
A.含有1 mol NH3分子? B.含NH3和NH 之和为1 mol?
之和为1 mol?
C.含NH3·H2O 1 mol? D.含NH3、NH3·H2O、NH4+之和为1 mol
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末化学试卷(解析版) 题型:选择题
关于电解NaCl溶液,下列叙述正确的是
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
查看答案和解析>>
科目:高中化学 来源:2014-2015辽宁省大连市高二上学期期末化学试卷(解析版) 题型:选择题
常温下,将甲酸(HCOOH)和氢氧化钠溶液混合,所得溶液 pH=7,则此溶液中
A.c(HCOO-) >c(Na+) B.c(HCOO-) <c( Na+)
C.c(HCOO-) =c(Na+) D.无法确定c(HCOO-) 与c(Na+) 的关系
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省等三校高一12月联考化学试卷(解析版) 题型:选择题
某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO-与ClO的物质的量浓度之比为11∶1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素的物质的量之比为
A.1∶3 B.4∶3 C.2∶1 D.3∶1
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
有关化学实验的下列操作中,一般情况下不能相互接触的是
A.过滤操作中,玻璃棒与三层滤纸
B.过滤操作中,漏斗径与烧杯内壁
C.分液操作中,分液漏斗径与烧杯内壁
D.用胶头滴管向试管滴液体时,滴管尖端与试管内壁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com