

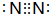 ����д����b����c�Ļ�ѧ����ʽ4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O
����д����b����c�Ļ�ѧ����ʽ4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O���� ��1��a��һ�ֳ�����������Ϊ���ʣ�b��������Ϊ���⻯���c��d���������c��d����֪����Ԫ���DZ��Ԫ�أ���a��N2��c��NO��d��NO2����a��b��c����֪b��NH3��e������������Ӧ��ˮ�������e��HNO3��
��2��a��һ�ֵ���ɫ��ĩ������Ϊ���ʣ���a��S��b�����壬c��d����������ת����ϵ��֪��b��H2S��c�Ƕ�������d����������e������������Ӧ��ˮ�������e��H2SO4��
��� �⣺��1��a��һ�ֳ�����������Ϊ���ʣ�b��������Ϊ���⻯���c��d���������c��d����֪����Ԫ���DZ��Ԫ�أ���a��N2��c��NO��d��NO2��b�����壬��a��b��c����֪b��NH3��e������������Ӧ��ˮ�������e��HNO3��
�����ĵ���ʽΪ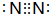 ���ɰ�������NO�Ļ�ѧ����ʽ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
���ɰ�������NO�Ļ�ѧ����ʽ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
�ʴ�Ϊ��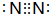 ��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
��4NH3+5O2$\frac{\underline{����}}{��}$4NO+6H2O��
��2��a��һ�ֵ���ɫ��ĩ������Ϊ���ʣ���a��S��b�����壬c��d����������ת����ϵ��֪��b��H2S��c�Ƕ�������d����������e������������Ӧ��ˮ�������e��H2SO4��
���ڷǽ�����S��Cl�����⻯���ȶ���H2S��HCl��
Fe��NO3��3��H2SO4�����ʵ����ֱ�Ϊ0.2mol��1.5mol��n��Fe��=$\frac{39.2g}{56g/mol}$=0.7mol��������ΪHNO3��Fe3+��H+����
Fe+4H++NO3-�TFe3++NO��+2H2O
1 4 1
0.6 2.4 0.6
���������ȫ����ԭ������NOΪ0.6mol���÷�Ӧ����0.6molFe3+����Һ��Fe3+Ϊ0.6mol+0.2mol=0.8mol��ʣ��FeΪ0.7mol-0.6mol=0.1mol
Fe+2Fe3+�T3Fe2+
1 2 3
0.1 0.2 0.3
Fe��ȫ��Ӧ��û��ʣ�࣬��Һ�д���Fe3+Ϊ0.8mol-0.2mol=0.6mol
�ʴ�Ϊ������0.6��0.6��
���� ���⿼��������ƶϣ��漰S��NԪ�ػ�����������ת�����������ʵ���ɫ��״̬��ת����ϵ���ɷ��������Ҫѧ����������Ԫ�ػ��������ʣ�ע��������ѧ����������Ӧ������ת����ϵ����2���м�����ȷ�����Ļ�ѧ��Ӧ����Ӧ���Ⱥ�˳���ǽ���Ĺؼ���


 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
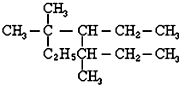 ��������3��3��5-����-4-�һ����飮
��������3��3��5-����-4-�һ����飮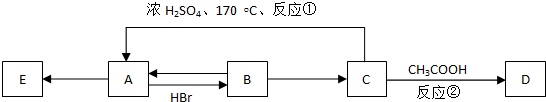
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | ʵ �� �� �� | �� �� |
| A | ������ƿ������Һʱ��������ҡ�Ⱥ�Һ����ڿ̶��ߣ�����ˮ����̶�����ƽ | ������ҺŨ�Ȳ���Ӱ�� |
| B | ��ʪ���pH��ֽ�ⶨ��ˮ��pH | ������Һ��pHƫ�� |
| C | ȡ������Һ���Թ��У�����ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ������������� | ����ɫʯ����ֽ���� ����ȡ��Һ��NH4+ |
| D | ��������ƽ��ȡһ��������NaCl���壬���̷����룬���̷Ź��� | ����NaCl����һ��ƫС |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ԣ�Al��OH��3��Mg��OH��2��NaOH | B�� | ���ԣ�HClO4��H2SO4��H3PO4 | ||
| C�� | ��ԭ�ԣ�HCl��HBr��HI | D�� | ԭ�Ӱ뾶��S��Na��O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����������ÿ����ԭ�Ӷ��ﵽ��8�����ȶ��ṹ | |
| B�� | 1 mol H2��������2 mol H�������� | |
| C�� | 1 mol H2����2 mol HҪ�ų�437.6 kJ���� | |
| D�� | ��ԭ�Ӳ�������ӻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C14H30 | B�� | C15H32 | C�� | C16H34 | D�� | C17H36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| X | Y | ���� | װ�� | |
| A | ��ˮ | ʯ�� | ��Һ�ȱ�����ɫ | 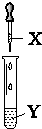 |
| B | ��ˮ | AgNO3��Һ | �Ȳ������������ܽ� | |
| C | NaOH��Һ | AlCl3��Һ | ������ɫ�����Ҳ���ʧ | |
| D | ˫��ˮ | ���Ե���KI��Һ | ��Һ����ɫ |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com