
 联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )
联氨N2H4(熔点:1.4℃,沸点:113.5℃)是一种无色的可燃液体,可用作火箭和燃料电池的燃料.结合联氨的结构判断下列说法正确的是( )| A. | 联氨的晶体是原子晶体 | |
| B. | 联氨易溶于水 | |
| C. | 1 mol联氨分子中含有5NA个σ键和NA个π键 | |
| D. | 联氨分子是非极性分子 |
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| D. | 石油裂解可以得到更多的汽油,这种汽油是一种纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能为 (b-a+5.6c)/4 kJ•mol-1 | |
| D. | 磷元素的非金属性比氯强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只能与盐酸反应 | |
| B. | 既不能与盐酸反应又不能与氢氧化钠溶液反应 | |
| C. | 能与氢氧化钠溶液反应 | |
| D. | 既能与盐酸反应又能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
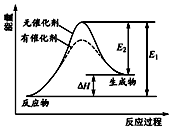 某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )
某反应的反应过程中能量变化如图所示(图中E1表示正反应的活化能,E2表示逆反应的活化能).下列有关叙述正确的是( )| A. | 加入催化剂,减小了反应的热效应 | |
| B. | 催化剂能降低反应的活化能 | |
| C. | 该反应的△H=E2-E1 | |
| D. | 该图可以表示燃料燃烧反应的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸盐都不稳定,都能自发分解 | |
| B. | 其分解是吸热反应,据能量判据不能自发分解 | |
| C. | 其分解是因为外界给予了能量 | |
| D. | 其分解是因为生成了易挥发的气体,使体系的熵增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:PH3<NH3 | B. | 金属性强弱:Na>Mg>Al | ||
| C. | 酸性强弱:HF>HCl>HBr>HI | D. | 原子半径:K>Si>Cl>F |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作与现象 | 结论 |
| A | 用玻璃棒蘸取某溶液进行焰色反应实验,火焰呈黄色 | 溶液中含有Na+ |
| B | 向浓度均为0.1mol•L-1的FeCl3和AlCl3混合溶液中滴加NaOH溶液,出现红褐色沉淀. | Ksp[Fe(OH)3]<Ksp[Al(OH)3] |
| C | 室温下,用pH试纸测得:0.1mol•L-1Na2CO3溶液的pH约为11;0.1mol•L-1NaHCO3溶液的pH约为8. | HCO3-结合H+的能力比CO32-的强 |
| D | 用Fe3+浓度相同的FeCl3溶液和Fe2(SO4)3溶液,分别清洗做完银镜反应的试管,FeCl3溶液清洗的干净 | 存在可逆过程:Fe3++Ag?Fe2++Ag+,且溶解度AgCl<Ag2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ③⑤ | C. | ②⑤ | D. | ①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com