
| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 64 | 70 | 80 | 90 | ||
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 30.5 | 27.0 | ||
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||||
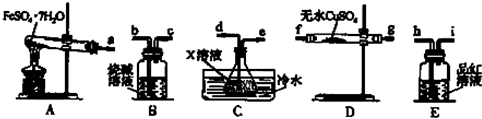
分析 以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程:废液结晶得到FeSO4•7H2O,加一定量硫酸溶解,抑制FeSO4的水解,加入碳酸氢铵,FeSO4溶液中加入碳酸氢铵经反应可生成碳酸亚铁固体和硫酸铵溶液,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成Fe2O3,依据图表数据分析,析出晶体FeSO4•7H2O的温度范围;
(1)亚铁离子水解显酸性,加一定量硫酸能抑制水解;
(2)亚铁离子与碳酸氢根离子反应生成碳酸亚铁沉淀和二氧化碳、水;
(3)FeCO3与氧气、水反应生成氢氧化铁和二氧化碳;
(4)实验装置A中FeSO4•7H2O分解生成的有二氧化硫、三氧化硫和水蒸气,B装置吸收尾气,C装置冷却是为了吸收三氧化硫,D装置无水硫酸铜检验产无水,E装置品红溶液检验SO2,
①分解生成的有二氧化硫、三氧化硫和水蒸气,利用图3装置可检验该反应的气体产物,先利用D装置检验生成的水蒸气,通过C装置冷却是为了吸收三氧化硫,通过装置E检验二氧化硫气体的存在,最后剩余气体通过B装置吸收尾气;
②装置C中是氯化钡溶液.
解答 解:以富含硫酸亚铁的废液为原料生产氧化铁,其主要流程:废液结晶得到FeSO4•7H2O,加一定量硫酸溶解,抑制FeSO4的水解,加入碳酸氢铵,FeSO4溶液中加入碳酸氢铵经反应可生成碳酸亚铁固体和硫酸铵溶液,碳酸亚铁固体经洗涤、干燥,在空气中灼烧时发生分解,且与空气中的氧气发生氧化还原反应,可生成Fe2O3,依据图表数据分析,0℃时析出晶体FeSO4•7H2O14g,t>56.7℃时析出晶体FeSO4•4H2O,所以析出晶体FeSO4•7H2O的温度范围应为t<56.7℃,
故答案为:t<56.7℃;
(1)步骤②需加一定量硫酸,除了保证铁屑充分反应外,由于亚铁离子水解显酸性,加过量硫酸,增大H+浓度,使Fe2++2H2O?Fe(OH)2+2H+的平衡向逆反应方向移动,从而抑制Fe2+的水解;
故答案为:抑制FeSO4的水解;
(2)亚铁离子与碳酸氢根离子反应生成碳酸亚铁沉淀和二氧化碳、水,其反应的离子方程式为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O,
故答案为:Fe2++2HCO3-═FeCO3↓+CO2↑+H2O;
(3)FeCO3与氧气、水反应生成氢氧化铁和二氧化碳,其化学方程式为:4FeCO3+6H2O+O2═4Fe(OH)3+4CO2,
故答案为:4FeCO3+6H2O+O2═4Fe(OH)3+4CO2;
(4)实验装置A中FeSO4•7H2O分解生成的有二氧化硫、三氧化硫和水蒸气,反应方程式为FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑,B装置吸收尾气,C装置冷却是为了吸收三氧化硫,D装置无水硫酸铜检验产无水,E装置品红溶液检验SO2,
故答案为:FeSO4•7H2O $\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑+14H2O↑;
①分解生成的有二氧化硫、三氧化硫和水蒸气,利用图3装置可检验该反应的气体产物,先利用D装置检验生成的水蒸气,通过C装置冷却是为了吸收三氧化硫,通过装置E检验二氧化硫气体的存在,最后剩余气体通过B装置吸收尾气,仪器的连接顺序为a、f(或g)、g(或f)、d、e、h、i、b,
故答案为:f(或g);g(或f);d;e;h;i;b;
②通过C装置冷却是为了吸收三氧化硫,装置C中的X为吸收三氧化硫的氯化钡溶液,
故答案为:氯化钡溶液.
点评 本题考查生产氧化铁化学工业流程、FeSO4•7H2O受热产物的检验,主要是物质性质和制备性质的理解和实验基本操作的分析判断,侧重于考查学生对所学知识的应用能力,及实验探究能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | SiO2是硅酸的酸酐,但不能由SiO2直接制硅酸 | |
| B. | 二氧化硅是通讯材料光导纤维的主要原料 | |
| C. | 氧化铝陶瓷、碳化硅陶瓷都是重要的高温结构陶瓷 | |
| D. | 二氧化硅熔点与干冰相差不大,它们都是酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na→Na2O2→NaOH→Na2CO3 | B. | Fe→FeCl2→Fe(OH)2→Fe(OH)3 | ||
| C. | Al→Al2O3→Al(OH)3→NaAlO2 | D. | Si→SiO2→Na2SiO3→H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO3溶液中存在:c (Na+)>c(SO32-)>c (H2SO3)>c (HSO3-) | |
| B. | 已知NaHSO3溶液pH<7,该溶液中:c (Na+)>c (HSO3-)>c (H2SO3)>c (SO32-) | |
| C. | 当吸收液呈酸性时:c (Na+)=c (SO32-)+c (HSO3-)+c (H2SO3) | |
| D. | 当吸收液呈中性时:c (Na+)=2 c (SO32-)+c (HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气中PM2.5值越高,大气污染越严重,由PM2.5引起的雾霾不一定属于胶体 | |
| B. | 装饰材料释放的苯、甲苯、甲醛等易挥发性烃类物质会导致室内空气污染 | |
| C. | 加热能杀死H7N9型禽流感病毒,是因为病毒的蛋白质受热变性 | |
| D. | 石墨烯(由石墨剥离而成的层状结构)可用于制造超级计算机,因其具有优异的导电性能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 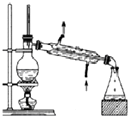 装置常用于分离互不相溶的液体混合物 装置常用于分离互不相溶的液体混合物 | |
| B. | 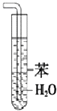 装置可用于吸收氨气,且能够防止倒吸 | |
| C. | 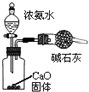 装置可用于制备少量NH3 | |
| D. | 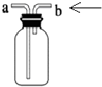 装置可用于收集O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ②④ | C. | ①③ | D. | ① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com