
【题目】关于乙酸的叙述不正确的是( )
A.可与乙醇反应B.能溶解鸡蛋壳
C.食醋中含有乙酸D.为一种无色无味的液体
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】硫酸锰在电解锰、染料、造纸以及陶瓷等工业生产中有广泛的应用。利用软锰矿(主要成分为MnO2,含铁的化合物等杂质)和闪锌矿(主要成分ZnS)制得硫酸锰的流程如下:
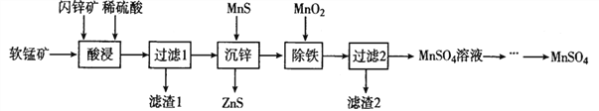
(1)“酸浸”时,为了缩短浸取时间,常加入少量FeSO4溶液,FeSO4的作用可能是___________________;MnO2、ZnS及硫酸反应转变为两种硫酸盐的化学方程式为______________________。
(2)常温下,Ksp(ZuS)=1.2×l0-24、Ksp(MnS)=1.5×10-15,“沉锌”反应为:Zn2+(aq)+MnS![]() ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
ZnS+Mn2+(aq),该反应的平衡常数K=__________________。
(3)在强酸性条件下加入MnO2氧化Fe2+的离子方程式为___________________。
(4)“除铁”时需要调节pH约为3~4,过滤所得的滤渣2中除MnO2以外的另一种物质是________________。(写化学式)
(5)该工艺流程中可以循环利用的物质是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中,反应2X(g)+Y2(g)![]() 2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是
2XY(g);△H<0,达到甲平衡.在仅改变某一条件后,达到乙平衡,下列分析正确的是

A. 图I中,甲、乙的平衡常数分别为K1、K2,则K1<K2
B. 图Ⅱ中,平衡状态甲与乙相比,平衡状态甲的反应物转化率低
C. 图Ⅱ中,t时间是增大了压强
D. 图Ⅲ是反应分别在甲、乙条件下达到平衡,说明乙温度高于甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应ClF(g)+F2(g) ![]() ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
ClF3(g) △H = -268 kJ·mol-1 在密闭容器中达到平衡。下列说法正确的是 ( )
A. 温度不变,缩小体积,ClF的转化率增大
B. 温度不变,增大体积,ClF3产率提高
C. 升高温度,增大体积,有利于平衡向正反应方向移动
D. 降低温度,体积不变,F2转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4 B.+3 C.+2 D.+1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下将3 mol CO2和2 mol H2混合于2 L的密闭容器中,发生如下反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g)
CO(g)+H2O(g)
(1)该反应的化学平衡常数表达式K=________。
(2)已知在700 ℃时,该反应的平衡常数K1=0.6,则该温度下反应CO(g)+H2O(g) ![]() CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g)
CO2(g)+H2(g)的平衡常数K2=________,反应1/2CO2(g)+1/2H2(g) ![]() 1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
1/2CO(g)+1/2H2O(g)的平衡常数K3=________。
(3)已知在1 000 ℃时,该反应的平衡常数K4为1.0,则该反应为________反应(填“吸热”或“放热”)。
(4)能判断该反应达到化学平衡状态的依据是________。(填编号)
A.容器中压强不变
B.c(CO2)=c(CO)
C.生成a mol CO2的同时消耗a mol H2
D.混合气体的平均相对分子质量不变
(5)在1 000 ℃下,某时刻CO2的物质的量为2.0 mol,则此时v正________v逆(填“>”、“=”或“<”)。该温度下反应达到平衡时,CO2的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有反应aA(g)+bB(g) ![]() pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
pC(g),已知:达到平衡后,升高温度,B的转化率变大;减小压强,C的质量分数减小。
(1)该反应的逆反应是________反应(填“放热”或“吸热”),且a+b______p(填“<”、“>”或“=”)。
(2)温度、容器体积不变,平衡后加入B,A的转化率_________,B的转化率_________。(填“增大”、“减小”或“不变”)
(3)若升高温度,再次平衡时,B、C的浓度之比将_____________。(填“增大”、“减小”或“不变”)
(4)若加入催化剂,再次平衡时气体混合物的总物质的量___________。(填“增大”、“减小”或“不变”)
(5)若B是有色气体,A、C无色,平衡后压缩容器体积为原来的一半,再次平衡时,容器内气体颜色____。若维持容器内气体压强不变,充入Ne,再次平衡时,容器内气体颜色__________。(填“变深”、“变浅”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.向蛋白质溶液中加入CuSO4溶液发生蛋白质变性
B.煤焦油中含有苯、二甲苯等化工原料
C.天然气和可燃冰的主要成分都是甲烷
D.石油裂解的主要目的是为了得到更多的汽油
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com