
| A. | ①②③④ | B. | ①②④⑤ | C. | ①②③④⑤⑦ | D. | ①②④⑤⑦ |
分析 由两种有机物组成的混合物,无论以何种比例混合,混合物的总质量一定,完全燃烧时产生的水的量均相等,则说明两种有机物分子中氢元素的质量分数相等,据此判断.
解答 解:由两种有机物组成的混合物,无论以何种比例混合,混合物的总质量一定,完全燃烧时产生的水的量均相等,则说明两种有机物分子中氢元素的质量分数相等.
①互为同分异构体,分子式相同,两种有机物分子中氢元素的质量分数相等,故①符合;
②最简式相同,两种有机物分子中氢元素的质量分数相等,故②符合;
③乳酸与聚乳酸中氢元素质量分数不同,故③不符合;
④有机物满足含氢的质量分数相同,故④符合;
⑤苯乙烯和聚苯乙烯的最简式相同,两种有机物分子中氢元素的质量分数相等,故⑤符合;
⑥葡萄糖与淀粉中氢元素质量分数不同,故⑥不符合;
⑦甲苯与甘油分子中H原子数目均为为8,二者相对分子质量相等,两种有机物分子中氢元素的质量分数相等,故⑦符合,
故选D.
点评 本题考查混合物的计算,目难度中等,关键在于明白混合物的总质量一定,完全燃烧生成水的质量也一定,则有机物分子中氢的质量分数相等.


科目:高中化学 来源: 题型:选择题
| A. | C-H之间是sp形成的σ键,C-C之间全是未参加杂化的2p轨道形成的π键 | |
| B. | C-C之间是sp形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相平行 | |
| D. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相垂直 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
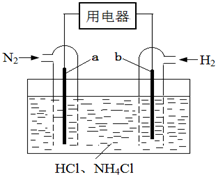 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
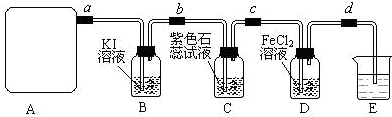
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
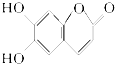
| A. | M的摩尔质量是180g/mol | |
| B. | 1 mol M最多能与2 mol Br2发生反应 | |
| C. | 1 mol M与足量NaHCO3反应能生成4 mol CO2 | |
| D. | M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
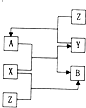 X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)
X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
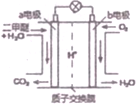 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| D. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
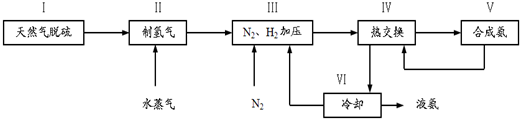
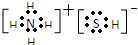 ,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
,写出再生反应的化学方程式:2NH4HS+O2=2S↓+2NH3•H2O.NH3的沸点高于H2S,是因为NH3分子之间存在着一种比分子间作用力更强的作用力.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com