
【题目】金刚石和石墨是碳元素的两种结构不同的单质(同素异形体),在100kPa时,1mol石墨转化为金刚石,要吸收1.895kJ的热能,据此,试判断在100kPa下,下列结论正确的是( )
A. 石墨比金刚石稳定
B. 金刚石比石墨稳定
C. 1mol石墨比1mol金刚石总能量高
D. 金刚石转化为石墨是物理变化
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由 这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气 体,q的水溶液具有漂白性,r的水溶液是一种强酸,s通常是难溶于水的油状混合物。上述物质的转化关系如图所示,下列说法正确的是( )

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. Y的氢化物常温常压下为液态
D. X的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸亚铁(白色固体,难溶于水)是一种重要的工业原料,可用于制备补血剂乳酸亚铁,也可用作可充电电池的电极。某研究小组通过下列实验,寻找利用复分解反应制备 FeCO3 沉淀的最佳方案:
实验 | 试剂 | 现象 | |
滴管 | 试管 | ||
| 0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L Na2CO3 溶液 (pH=11.9) | 实验Ⅰ:立即产生灰绿色沉淀,5min 后出现明显的红褐色 |
0.8 mol/L FeSO4 溶液(pH=4.5) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅱ:产生白色沉淀及少量无色气泡,2min 后出现明显的灰绿色 | |
0.8 mol/L (NH4)2Fe(SO4)2 溶液(pH=4.0) | 1 mol/L NaHCO3 溶液 (pH=8.6) | 实验Ⅲ:产生白色沉淀及无色气泡,较长时间保持白色 | |
(1)实验 I 中红褐色沉淀产生的原因可用如下反应表示,请补全反应:
□Fe2+ +□____+□ + □H2O=□ Fe(OH)3 +□HCO3
(2)实验 II 中产生 FeCO3 的离子方程式为_____________________________。
(3)为了探究实验 III 中 NH4+所起的作用,甲同学设计了实验 IV 进行探究:
操作 | 现象 | |
实验 IV | 向 0.8 mol/L FeSO4 溶液中加入①__________,再加入 Na2SO4 固体配制成混合溶液(已知 Na+对实验无影响,忽略混合后溶液体积变化)。再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合 | 与实验 III 现象相同 |
实验 IV 中加入 Na2SO4 固体的目的是②_______________________。
对比实验 II、III、IV,甲同学得出结论:NH4+水解产生 H+,降低溶液 pH,减少了副产物 Fe(OH)2 的产生。
乙同学认为该实验方案不够严谨,应补充的对比实验操作是:③_____________,再取该溶液一滴管,与 2mL 1 mol/L NaHCO3 溶液混合。
(4)小组同学进一步讨论认为,定性实验现象并不能直接证明实验 III 中 FeCO3 的纯度最高,需要利用如图所示的装置进行定量测定。分别将实验 I、II、III 中的沉淀进行过滤、洗涤、干燥后称量,然后转移至 A 处的广口瓶中。
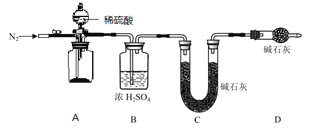
为测定 FeCO3 的纯度,除样品总质量外,还需测定的物理量是______________________。
(5)实验反思:经测定,实验 III 中的 FeCO3 纯度高于方案 I 和方案 II。通过以上实验分析,制备 FeCO3 实验成功的关键因素是_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是石蜡油在炽热碎瓷片的作用下产生乙烯并检验其性质的实验,完成下列问题。
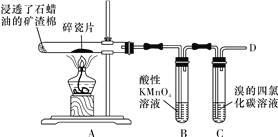
(1)A中碎瓷片的作用是____________。
(2)乙烯的电子式为__________________。
(3)下列物质中,可以通过乙烯的加成反应得到的是______(填字母代号)。
A.CH3CH3 B.CH3CHCl2
C.CH3CH2OH D.CH3CH2Br
(4)运输水果时,为了吸收水果产生的乙烯,防止水果早熟腐烂,常将浸泡有_______溶液的硅藻土放置在盛放水果的容器中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳族元素( Carbongroup)是位于元素周期表ⅣA族的元素,包括碳(C)、硅(Si)、锗(Ge)、锡(Sn)、铅(Pb)、鈇(Fl)六种。请回答
(1)鈇(Fl),其命名是为了纪念苏联原子物理学家乔治·弗洛伊洛夫,是一种人工合成的放射性化学元素,它的化学符号是Uuq,它的原子序数是____________,属于弱金属之一。
(2)基态锡原子价电子的轨道表示式为________________与其同周期且未成对电子数相同的元素还有______种.
(3)晶体硅的密度为ρg/cm3其晶胞结构与金刚石相似,若硅原子半径为r pm,NA表示阿伏加德罗常数的值,M(Si)表示硅的相对原子质量,则硅晶胞中原子的体积占晶胞体积的百分率为__________用含ρ、r、NA、M(Si)的代数式表示]。
(4)GeO2、SiO2均为共价型化合物,熔点分别为1388K、1983K,则GeO2为______(填晶体类型),SiO2的熔点高于GeO2的原因为______________.
(5)三氯甲烷(Trichloromethane)为无色透明液体。有特殊气味,味甜,低毒,有麻醉性。有致癌可能性。三氯甲烷的VSEPR模型为_____,与三氯甲烷互为等电子体的阴离子为________(任写一种)。
(6)石墨烯研究近年有了长足发展。2017年,清华任天令团队曾首次实现石墨烯智能人工喉,贴附在聋哑人喉部便可以辅助聋哑人“开口说话”。石墨烯与金属R可以形成一种插层化合物。其中R层平行于石墨层,晶胞如图甲所示,其垂直于石墨层方向的投影如图乙所示。则该插层化合物的化学式为________;若碳碳键的键长为apm,则同层最邻近的两个钾原子之间的距离为_________pm。(用含a的代数式表示)
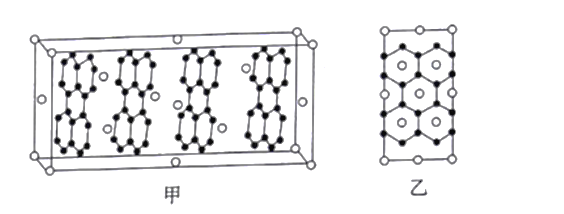
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A.Al(OH)3受热能分解
B.Al2O3既能溶于强酸溶液又能溶于强碱溶液
C.Al(OH)3胶体能吸附水中的悬浮物
D.Al(OH)3能溶于过量的浓氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:1molH2(g)与1molBr2(g)完全反应生成2molHBr(g)时放出72kJ的热量,有关物质的相关数据如下表:则表中a为
化学键 | H-H | Br- Br | H-Br |
断裂1mol化学键需要吸收的能量/kJ | 436 | a | 369 |
A. 200B. 230C. 260D. 404
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com