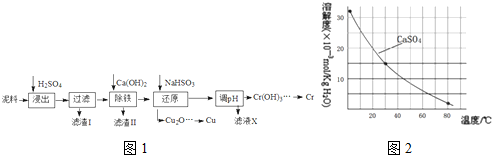
考点:金属的回收与环境、资源保护,难溶电解质的溶解平衡及沉淀转化的本质
专题:金属概论与碱元素
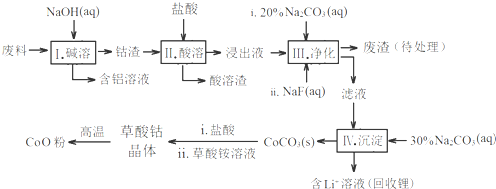
分析:废料加入氢氧化钠溶液碱浸,得到钴渣,加入盐酸溶解后防晒霜氧化还原反应,氧化钴氧化氯离子为氯气,过滤得到酸溶的溶液加入碳酸钠溶液和NaF溶液净化,除去锂离子和铁离子,在滤液中加入碳酸钠溶液沉淀钴离子为碳酸钴沉淀,加入盐酸和草酸铵溶液得到草酸钴晶体,高温分解得到氧化钴;
(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子;
(4)NaF与溶液中的Li
+形成LiF沉淀,防止锂离子结合碳酸根离子形成碳酸锂沉淀;
(5)计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC
2O
4,210~290℃过程中是CoC
2O
4发生的反应,210~290℃过程中产生的气体只有CO
2 ,依据元素守恒得到生成CO
2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明不是分解反应,参加费用的还有氧气,则反应的氧气质量=2.64g-2g=0.64g,O
2物质的量=
=0.02mol,依据原子守恒配平书写反应的化学方程式.
解答:
解:(1)步骤Ⅰ中得到含铝溶液是铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,反应的化学方程式为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;
故答案为:2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑;
(2)氧化钴氧化盐酸溶液中氯化氢为氯气,结合原子守恒和电子守恒分析配平书写离子方程式,钴元素化合价降低为+2价.氯元素化合价-1价变化为0价,反应的离子方程式:Co
2O
3+6H
++2Cl
-=2Co
2++Cl
2↑+3H
2O
故答案为:Co
2+;Cl
2;
(3)依据表中数据分析判断加入碳酸钠调节溶液PH,沉淀铁离子和锂离子,但不能沉淀钴离子,步骤Ⅲ中Na
2CO
3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15,废渣中的主要成分除了LiF外还有Fe(OH)
3;
故答案为:7.15;Fe(OH)
3;
(4)NaF与溶液中的Li
+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是,降低溶液中Li
+浓度,避免步骤Ⅳ中产生Li
2CO
3沉淀;
故答案为:降低溶液中Li
+浓度,避免步骤Ⅳ中产生Li
2CO
3沉淀;
(5)计算晶体物质的量n=
=0.03mol,失去结晶水应为0.06mol,固体质量变化=0.06mol×18g/mol=1.08g,图表数据可知,150~210固体质量变化=5.49g=4.41g=1.08g,说明210°C失去结晶水得到CoC
2O
4,210~290℃过程中是CoC
2O
4发生的反应,产生的气体只有CO
2 ,依据元素守恒得到生成CO
2物质的量为0.06mol,质量=0.06mol×44g/mol=2.64g,气体质量共计减小=4.41g-2.41g=2g,说明说明有气体参加反应应为氧气,则反应的氧气质量=2.64g-2g=0.64g,O
2物质的量=
=0.02mol;n(CoC
2O
4):n(O
2):n(CO
2)=0.03:0.02:0.06=3:2:6,依据原子守恒配平书写反应的化学方程式为3CoC
2O
4+2O
2Co
3O
4+6CO
2,故答案为:3CoC
2O
4+2O
2Co
3O
4+6CO
2.
点评:本题考查了流程分析判断,物质性质的理解应用,主要是固体受热过程中质量变化来计算及化学方程式书写,掌握基础是关键,题目难度中等.



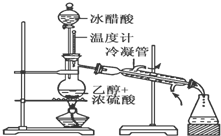 实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)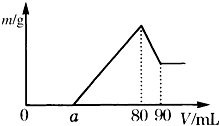 把一定质量的镁、铝混合物投入到1mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则:
把一定质量的镁、铝混合物投入到1mol?L-1的盐酸中,待金属完全溶解后,向溶液中加入1mol?L-1的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示.则: