
分析 (1)根据NO2的颜色、易溶于水的物理性质以及NO2和H2O反应生成一氧化氮和硝酸等解答;
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,由此解答;
解答 解:(1)由于红棕色的NO2易溶于水,发生反应3NO2+H2O═2HNO3+NO,故气体颜色消失,3molNO2反应生成1molNO,气体体积减少到原先的$\frac{1}{3}$,故液面上升至容积的$\frac{2}{3}$处,故答案为:红棕;$\frac{1}{3}$;无;3NO2+H2O═2HNO3+NO;
(2)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑,故答案为:2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑.
点评 本题考查了氮的氧化物的性质、化学方程式的书写,题目难度中等,注意掌握氮的氧化物的性质,明确氧化还原反应的实质及配平方法,试题培养了学生灵活应用所学知识的能力.


 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
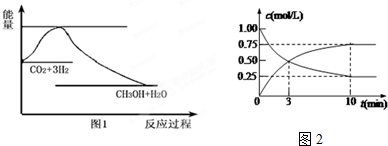
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| B. | 纯净的H2在Cl2中安静地燃烧,发出苍白色火焰 | |
| C. | 氯气通入品红溶液中,溶液会褪色,是因为氯气具有漂白性 | |
| D. | 氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤ | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
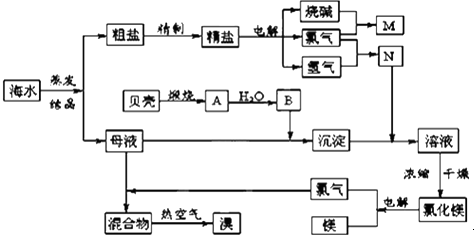
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL0.1mol•L-1FeCl3溶液中含有Fe3+的数目为0.01NA | |
| B. | 在铜与单质硫的反应中,1mol铜失去的电子数为2NA | |
| C. | 15.6g由Na2S和Na2O2组成的固体混合物中,含有的阴离子数为0.2NA | |
| D. | 104g苯乙烯(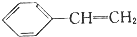 )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA )中含有碳氢键的数目和碳碳双键的数目分别为8NA和4NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com