
| A.2.4g | B.3.36g | C.5.60g | D.6.4g |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述I | 陈述II | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | I对;II对;有 |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | I对;II对;无 |
| C | 铁属于过渡金属元素 | 铁和铁的某些化合物可以用作催化剂 | I错;II对;无 |
| D | 铁在空气中表面生成致密氧化膜 | 可用铁罐储存运输浓硫酸、浓硝酸 | I对;II对;有 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.②④⑤ | C.①③⑥ | D.①②⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铝片表面的紫红色沉积物为Cu ,离子方程式为2Al+3Cu2+=3Cu+2Al3+ |
| B.生成的气体是H2,生成的蓝色沉淀为Cu(OH)2,产生该现象的离子方程式为3Cu2++6H2O+2Al=3Cu(OH)2↓+3H2↑+2Al3+ |
| C.一段时间后反应速率明显加快的原因一定是;反应放热,使溶液温度升高,反应速率加快 |
| D.溶液中出现的黑色物质可能是氧化铜 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
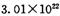 个 B原混合物:
个 B原混合物: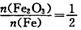
 D .所得溶液:
D .所得溶液:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
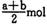 B (a — b) mol
B (a — b) mol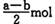 D. (a+b) mol
D. (a+b) mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
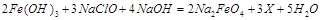 ,则X的化学式为 。
,则X的化学式为 。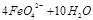

 。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。
。由此看来,高铁酸钠能够杀菌消毒是因为它具有 性,而能够除去水中悬浮物是因为 。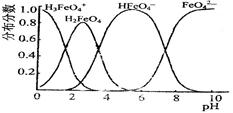

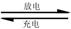
 则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。
则电池正极材料是 ,充电时电池正极 (填“得”“失”)电子,放电时电池的负极反应式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溶解的铁粉为2.8g | B.原溶液中C(SO42-)=0.5mol/L |
| C.原混合溶液中C(H+)=1.2mol/L | D.原溶液中n(NO3-)=0.08mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com