
| A. | 1molFe溶于过量硝酸,电子转移数为2NA | |
| B. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| C. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA | |
| D. | 14g乙烯和丙烯混合气体中的氢原子数为2NA |
分析 A.铁与足量硝酸反应生成硝酸铁;
B.氮气和氢气合成氨气为可逆反应;
C.气体摩尔体积使用对象为气体;
D.乙烯和丙烯的最简式均为CH2.
解答 解:A.1molFe溶于过量硝酸生成硝酸铁,电子转移数为3NA,故A错误;
B.氮气和氢气合成氨气为可逆反应,1molN2与4molH2反应生成的NH3分子数为小于2NA,故B错误;
C.标况下四氯化碳为液体,不能使用气体摩尔体积,故C错误;
D.乙烯和丙烯的最简式均为CH2,故14g混合物中含1molCH2,故含2NA个氢原子,故D正确;
故选:D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积使用条件和对象,题目难度不大.


 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:选择题
| A. | 明矾溶液具有酸性,可用于清除铜镜表面的铜锈 | |
| B. | 晶体硅熔点高、硬度大,可用于制作半导体材料 | |
| C. | 氨气能使酚酞试液变红,可用于设计喷泉实验 | |
| D. | 氧化铁能与酸反应,可用于制作红色颜料 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
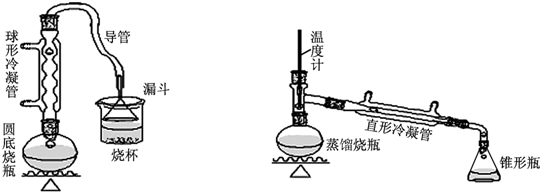
| 物质 | 熔点/℃ | 沸点/℃ |
| 1-丁醇 | -89.5 | 117.3 |
| 1-溴丁烷 | -112.4 | 101.6 |
| 丁醚 | -95.3 | 142.4 |
| 1-丁烯 | -185.3 | -6.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是日常生活中用途最广、用量最大的金属材料.
铁是日常生活中用途最广、用量最大的金属材料.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ④⑤⑥⑦ | C. | ②⑥ | D. | ①②③④⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无水CuSO4 | B. | CuO | C. | Cu(OH)2 | D. | CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
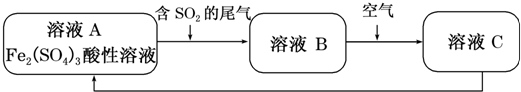
| A. | 向C溶液中滴加KSCN溶液,溶液变为血红色 | |
| B. | 溶液B转化为溶液C发生的变化的离子方程式为4H++2Fe2++O2═2Fe3++2H2O | |
| C. | 溶液酸性A>B>C | |
| D. | 加氧化亚铁可以使溶液C转化为溶液A |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com