
下列各组溶液中只用试管和胶头滴管,通过互滴不能鉴别的是:( )
A. KOH和Al2(SO4)3 B. 稀HCl和Na2CO3
C. 稀HCl和Na[Al(OH)4] D. Ca(OH)2和NaHCO3
 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源:2017届湖北省、襄阳五中、襄阳四中等)高三下学期第二次联考理综化学试卷(解析版) 题型:选择题
H3BO3可以通过电解NaB(OH)4溶液的方法制备,其工作原理如图,下列叙述错误的是( )
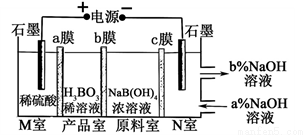
A. M室发生的电极反应式为:2H2O-4e- = O2↑+4H+
B. N室中:a% <b%
C. b膜为阴膜,产品室发生反应的化学原理为强酸制弱酸
D. 理论上每生成1mol产品,阴极室可生成标准状况下5.6L气体
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,含NA个分子的H2、CO混合气体的体积约为22.4L
B. 56g铁与一定量的氯气在一定条件下充分反应,转移的电子数一定是3NA
C. 28g乙烯与C3H8的混合物中含有C—H键的数目为4NA
D. 常温下,pH=11的NaOH溶液中由水电离出的H+数目为0.001NA
查看答案和解析>>
科目:高中化学 来源:2017届浙江省教育绿色评价联盟高三3月适应性考试(选考)化学试卷(解析版) 题型:选择题
下列物质的水溶液因水解而呈碱性的是
A.NaCl B.NH4Cl C.NaHCO3 D.NaOH
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:填空题
A、B、C、D、E均为短周期元素,且原子序数依次增大;A的主族序数、周期数、原子序数均相同;B为非金属元素,其单质有多种同素异形体,其中一种可作电极材料;C是植物生长所需的主要元素之一;D和A可形成A2D和A2D2,A2D是最常见的溶剂;E原子次外层电子电子数等于其它层电子数之和。则
(1)E在周期表中的位置是______________,B、C、D、E与A形成的化合物中稳定性最强的是_______(该化学式)。
(2)C、D、E的离子半径由大至小顺序______________。
(3)写出B与由A、C、D组成的化合物的浓溶液在加热条件下的反应方程式:_________。
(4)A-E五种元素中,含同一元素的各类物质能实现下列转化的有______(填元素符号)。
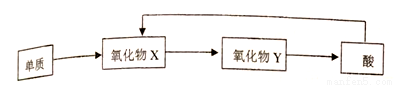
(5)A2D2与FeSO4溶于稀硫酸,反应的离子方程式为_________。
(6)由A、B、C、D四种元素组成的化合物A,其原子个致比为7: 2 : l : 2,则A为(名称)__________。
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:选择题
若将铝粉分别加入下列溶液中,能放出氢气,且可能大量共存的是( )
A.H+、Ba2+、Cl-、NO3- B.NH4+、CO32-、NO3-、Na+
C.NO3-、K+、[Al(OH)4] -、OH- D.Na+、Ba2+、Mg2+、HCO3-
查看答案和解析>>
科目:高中化学 来源:福建省2016-2017学年高一3月月考化学试卷 题型:选择题
下列表述正确的是:( )
① 人造刚玉的熔点很高,可用作高级耐火材料,主要成分是二氧化硅
② 化学家采用玛瑙研钵摩擦固体反应物进行无溶剂合成,玛瑙的主要成分是硅酸盐
③ 提前建成的三峡大坝使用了大量水泥,水泥是硅酸盐材料
④ 水晶项琏和餐桌上的瓷盘都是硅酸盐制品
⑤大阳能电池可采用硅材料制作,其应用有利于环保、节能
A. ①②③ B. ②④ C. ③④⑤ D. ③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二下学期第一次月考化学试卷(解析版) 题型:选择题
绿原酸的结构简式如下图,则下列有关绿原酸的说法不正确的是
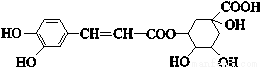
A.分子式为C16H18O9
B.既可以与氢气发生加成反应,又可以使酸性KMnO4溶液褪色
C.还能发生取代、加聚、消去等反应
D.在镍做催化剂的情况下,1 mol绿原酸发生加成反应最多可消耗6 mol 氢气
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省沙市高一下学期第三次双周考(A卷)化学试卷(解析版) 题型:简答题
碳及其含碳化合物在人们的生产生活中应用广泛。
(1)将不同量的CO2(g)和H2(g)分别通入到体积为2L的恒容密闭容器中,进行反应2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),得到如表三组数据;
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需 时间/min | ||
CO2 | H2 | H2 | C2H5OH | |||
1 | 650 | 2 | 6.8 | 2.0 | 0.8 | 6 |
2 | 900 | 2 | 4.4 | 2.0 | 0.4 | 3 |
3 | 900 | 4 | 8.8 | C | d | t |
①实验1中以v(H2)表示的反应速率为________________
②已知在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数称之为化学平衡常数。900℃化学平衡常数为______________,
③如果改变影响平衡的条件之一(如温度,压强,反应物的浓度)平衡将向着能够减弱这种改变的方向移动。则第3组与第2组相比CO2的转化率___________(填“增大”“减小”“不变” 不能确定).
(2)将CH4设计成燃料电池,其利用率更高,装置示意如图(A、B为多孔性碳棒). 持续通入甲烷,在标准状况下,消耗甲烷体积VL.
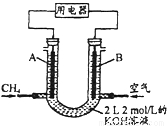
①0<V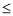 44.8L时,负极电极反应为_________________
44.8L时,负极电极反应为_________________
②44.8L<V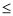 89.6L时,电池总反应方程式为_____________
89.6L时,电池总反应方程式为_____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com