
分析 根据价层电子对互斥理论确定分子或离子空间构型,价层电子对个数=σ键个数+孤电子对个数,σ键个数=配原子个数,孤电子对个数=$\frac{1}{2}$(a-xb),a指中心原子价电子个数,x指配原子个数,b指配原子形成稳定结构需要的电子个数.根据n值判断杂化类型:一般有如下规律:当n=2,sp杂化;n=3,sp2杂化;n=4,sp3杂化;中心原子的杂化类型为sp2,说明该分子中心原子的价层电子对个数是3,无孤电子对数,空间构型是平面三角形;单键中只有σ键,双键中有一个σ键和一个π 键,三键中有一个σ键和两个π 键,据此分析解答.
解答 解:(1)SCl4 中S原子和氯原子形成4个σ键,孤电子对个数=$\frac{1}{2}$×(6-4×1)=1,价层电子对数为=4+1=5,为sp3d杂化,分子立体构型为三角双锥形,
故答案为:sp3d杂化,三角双锥形;
(2)BCl3中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{3-3×1}{2}$=3,所以原子杂化方式是sp2,分子形状为平面三角形,
故答案为:sp2杂化,平面三角形;
(3)CS2中C原子形成2个δ键,孤对电子数为$\frac{4-2×2}{2}$=0,则为sp杂化,为直线形,
故答案为:sp杂化,直线形;
(4)PO43- 中P原子价层电子对个数=4+$\frac{5+3-4×2}{2}$=4且不含孤电子对,所以原子杂化方式是sp3,磷酸根离子空间构型为正四面体结构,
故答案为:sp3杂化,正四面体结构;
(5)Cl2O 中O原子价层电子对个数=2+$\frac{6-1×2}{2}$=4,含2个孤电子对,所以原子杂化方式是sp3,分子形状为V形,
故答案为:sp3杂化,V形;
(6)C6H6分子中碳原子杂化轨道数为3,所以采取sp2杂化,分子形状为平面正六边形,
故答案为:sp2杂化,平面正六边形.
点评 本题考查了原子杂化方式及分子或离子的立体构型的判断,侧重分子或离子结构与性质的考查,注意杂化轨道理论的理解应用,把握常见分子或离子中原子的杂化及空间构型为解答的关键,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中Fe3+的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 邻羟基苯甲酸中加入足量NaHCO3溶液: +2HCO${\;}_{3}^{-}$→ +2HCO${\;}_{3}^{-}$→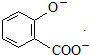 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚钠溶于醋酸溶液:C6H5O-+H+→C6H5OH | |
| B. | 用稀硝酸除去试管内壁银:Ag+2H++NO3-═Ag++NO2↑+H2O | |
| C. | 酯的水解反应:CH3CH2OOCCH3+H218O$?_{△}^{稀H_{2}SO_{4}}$CH3CH2OH+CH3CO18OH | |
| D. | 乙醛的银镜反应:CH3CHO+2Ag(NH3)2OH$\stackrel{△}{→}$CH3COO-+NH4++2Ag↓+3NH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
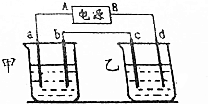 按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】
按如图的实验装置进行实验,其中a、b、c、d均为惰性电极.电解质溶液分别为硫酸铜溶液和饱和氧化钠溶液,通电一段时间后,根据下列现象作出判断:【假设电解质均足量】查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Cu一定为正极 | |
| B. | 若溶液中的阴离子移向铁电极,则电流由铜电极经导线流向铁电极 | |
| C. | 若铜电极增重,则X可能为CuSO4、AgNO3、FeCl3等 | |
| D. | 若铜电极溶解,则铁电极表面可能有无色刺激性气味的气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定有乙烷 | B. | 一定有甲烷 | C. | 一定没有甲烷 | D. | 不一定有甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该物质的分子式为C16H14O3 | |
| B. | 该物质分子中的所有碳原子可能共平面 | |
| C. | 滴人KMnO4(H+)溶液,可观察到紫色褪去,不能证明结构中存在碳碳双键 | |
| D. | 1mol该物质分别与NaOH、浓溴水和H2反应时最多消耗NaOH、Br2和H2分别为3mol、4mol、7mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 右上方区域的非金属元素 | |
| B. | 过渡区域的金属元素 | |
| C. | 金属元素和非金属元素分界线附近的元素 | |
| D. | 稀有气体元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com