
【题目】对于反应:I2(g)+H2(g)2HI(g),在密闭容器中进行,下列条件能加快化学反应速率的是( )
A.缩小体积使压强增大B.体积不变充入He使气体压强增大
C.体积不变使压强减小D.使总压强不变,充入Ne
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某有机物的结构如图所示:
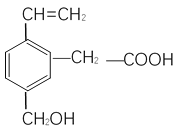
(1)此有机物中含官能团的名称_________________ (至少写两个)
(2)这种有机物不可能具有的性质是__________
A.能跟NaOH溶液反应 B.能使酸性KMnO4溶液褪色
C.1mol此有机物能与1molH2 加成 D.能发生酯化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工采用稀NaOH溶液脱除CO2,若碱洗脱除后所得废液的pH约为13(已知:相同温度下饱和Na2CO3溶液的pH约为12),则下列说法正确的是
A. 该溶液中:c(OH-)>c(Na+)>c(CO32-)>c(HCO3-)>c(H+)
B. 该溶液中:c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-)
C. 加水稀释该溶液,恢复至原温度,pH增大,Kw不变
D. 该溶液pH约为13的原因:CO32-+H2O=HCO3-+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究NO2、NO、CO污染物处理,对建设美丽中国具有重要意义。
(1)①NO2(g)+CO(g)==CO2(g)+NO(g)△H1=-234.00kJ/mol
②1/2N2(g)+1/2O2(g)=NO(g)△H2=-89.75kJ/mol
③2NO(g)+O2(g)==2NO2(g)△H3=-112.30kJ/mol。
若NO2气体和CO气体反应生成无污染气体,其热化学方程式为______________。
(2)某温度下,向10L密闭容器中分别充入0.1molNO2和0.2molCO,发生反应:2NO2(g)+4CO(g)=N2(g)+4CO2(g),经10min反应达到平衡,容器的压强变为原来的![]() 。
。
①0~10min内,CO的平均反应速率v(CO)=__________;
②若容器中观察到_____,可判断该反应达到平衡状态;
③为增大污染物处理效率,起始最佳投料比为______;
④平衡后,仅将CO、CO2气体浓度分别增加一倍,则平衡_____(填“右移”或“左移”或“不移动”)。

(3)在高效催化剂作用下用NH3还原NO2进行污染物处理。
①相同条件下,选用A、B、C三种催化剂进行反应,生成氮气的物质的量与时间变化如图a。活化能最小的是______(用E(A)、E(B)、E(C)表示三种催化剂下该反应活化能)。
②在催化剂A作用下测得相同时间处理NO2的量与温度关系如图b。试说明图中曲线先增大后减小的原因________(假设该温度范围内催化效率相同)。

(4)有人设想在含有NO2的酸性污水中加人填充有铝粉的多孔活性炭颗粒进行水的净化。试结合电极反应说明多孔活性炭的主要作用_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】既可以用来鉴别甲烷和乙烯,又可以用来除去甲烷中混有的少量乙烯的操作方法是( )
A. 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶
B. 混合气体通过盛有足量溴水的洗气瓶
C. 混合气体通过盛有蒸馏水的洗气瓶
D. 混合气体与适量氯化氢混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用滴有氯化钠溶液的湿润的滤纸分别做甲、乙两个实验,下列判断正确的是
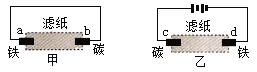
A. a极上发生还原反应
B. 铁片腐蚀速率:乙>甲
C. d为阴极,发生的反应为:Fe-2e→Fe2+
D. b极上发生的反应为:O2 + 2H2O + 4e → 4OH—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】做焰色反应实验用的铂丝,每试验一种样品后都必须 ( )
A. 用水洗涤2~3次后再使用 B. 用滤纸擦干后才可使用
C. 用盐酸洗涤后,经蒸馏水冲洗,方可使用 D. 用盐酸洗涤后,再在酒精灯火焰上灼烧到没有颜色,才可使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是
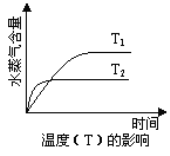
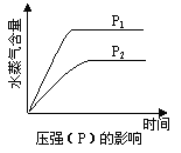
A. CO2(g) + 2NH3(g)![]() CO(NH2)2(s) + H2O(g); △H<0 ,△S<0
CO(NH2)2(s) + H2O(g); △H<0 ,△S<0
B. CO2(g) + H2(g)![]() CO(g) + H2O(g); △H>0,△S=0
CO(g) + H2O(g); △H>0,△S=0
C. CH3CH2OH (g)![]() CH2=CH2(g) + H2O(g); △H>0,△S>0
CH2=CH2(g) + H2O(g); △H>0,△S>0
D. 2C6H5CH2CH3(g) + O2(g)![]() 2 C6H5CH=CH2(g) + 2H2O(g); △H<0,△S>0
2 C6H5CH=CH2(g) + 2H2O(g); △H<0,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.1 mol·L-1的HR溶液中逐滴滴入0.1 mol·L-1的NH3·H2O溶液,所得溶液pH及导电性变化如图。下列分析不正确的是
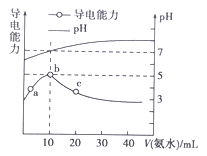
A. b点溶液pH=5,此时酸碱恰好中和
B. a~b点导电能力增强,说明HR为弱酸
C. c点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
D. b~c任意点溶液均有c(H+)·c(OH-)=Kw=1.0×10-14
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com