

| ||
| ||
| ||
| ||


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
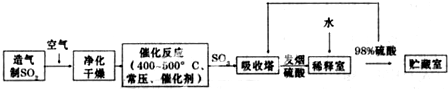
| 氧气 |
| 热空气或 |
| 水蒸气 |
| 碱液 |
| 吸收 |
| 酸化 |
| 蒸馏 |
| 煅烧 |
| 水 |
| 海水 |
| 过滤 |
| 灼烧 |
| 熔化 |
| 电解 |
| 放电 |
| 水 |
| 吸收 |
| 一定条件下 |
| 合成塔 |
| 过量氯气 |
| 水冷 |
| 分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:
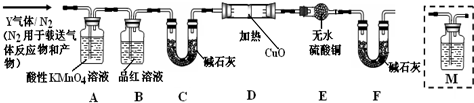
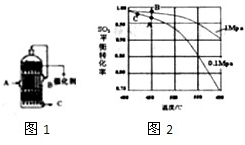
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验操作 | 实验现象或 预期实验现象 | 现象解释(用 离子方程式表示) | |
| 猜想② | 溶液pH=8 | ||
| 向pH=2的硫酸中 滴加Na2S2O3溶液 | 2S2O32-+2H+══S↓+SO2↑+H2O | ||
| 猜想③ | 向新制氯水中滴加少量Na2S2O3溶液 | 氯水颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:
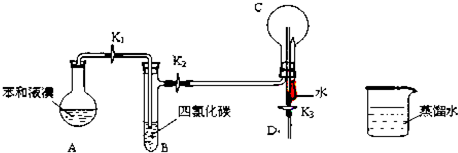
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
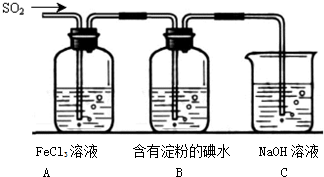
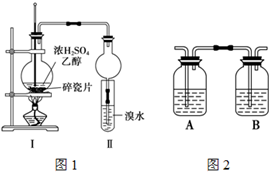 某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图1所示装置进行探究实验,以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、MnO4-、Cl-、Ba2+ |
| B、Na+、Ba2+、HCO3-、NO3- |
| C、K+、NO3-、CO32-、Cl- |
| D、Na+、H+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钠的水解反应:CO32-+H3O+═HCO3-+H2O |
| B、大理石溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
| C、氢氧化铁与氢碘酸混合:Fe(OH)3+3H+=Fe3++3H2O |
| D、向偏铝酸钠溶液中通入过量二氧化碳:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com