
【题目】《环境科学》刊发了我国科研部门采用零价铁活化过硫酸钠(Na2S2O8,其中S为+6价)去除废水中的正五价砷[As(V)]的研究成果,其反应机制模型如图所示。设阿伏加德罗常数的值为NA,Ksp[Fe(OH)3]=2.7×10-39。下列叙述正确的是
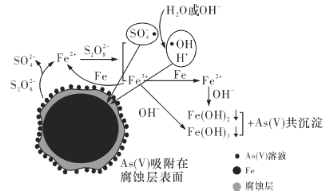
A.1 mol过硫酸钠(Na2S2O8)含2NA个过氧键
B.若56 g Fe参加反应,被还原的S2O82-大于NA个
C.室温下,中间产物Fe(OH)3溶于水所得饱和溶液中(假设pH接近7)c(Fe3+)为2.7×10-32 mol·L-1
D.pH越小,越有利于去除废水中的正五价砷
【答案】B
【解析】
A.1 mol过硫酸钠(Na2S2O8)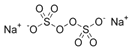 含1mol过氧键,含1NA个过氧键,故A错误;
含1mol过氧键,含1NA个过氧键,故A错误;
B.一个S2O82-和一个Fe反应生成两个SO42-和一个Fe2+,该过程转移2个电子,但是Fe2+还要与S2O82-反应变成Fe3+和自由基,因此1mol铁参加反应要消耗1.5molS2O82-,共有1.5NA个S2O82-被还原,被还原的S2O82-大于NA个,故B正确;
C.已知Ksp[Fe(OH)3]=2.7×10-39,此溶液碱性极弱,溶液的pH接近7,即c(OH-)=10-7mol·L-1,代入方程即可解得:c(Fe3+)=2.7×10-18mol·L-1,故C错误;
D.因为最后是将离子转变为沉淀析出的,则溶液的碱性越强越有利于析出,即pH越大越有利于去除废水中的正五价砷,故D错误;
故选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】加强废旧金属的回收和再利用,是合理开发和利用金属资源的主要途径之一。如图是从镀铜废电路板中回收金属铜的一种工艺流程(各过程需控制适宜条件)。

(1)上述流程中,为加快化学反应速率而采取的措施是_____。
(2)过程Ⅰ中,过氧化氢在酸性条件下将Cu溶解,该反应的离子方程式是_____。
(3)过程Ⅱ中加入过量铁粉的目的是_____,该过程中用到的分离操作是_____。
(4)过程Ⅲ中,发生反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X是第四周期元素,最外层只有1个电子,次外层的所有原子轨道均充满电子。元素Y基态原子的3p轨道上有2个未成对电子。元素Z 的原子最外层电子数是其内层的3倍。回答下列问题:
(1)元素X在元素周期表中位于___区,单质X的晶体类型为_____,其中X原子的配位数为_____。
(2)Z的氢化物在乙醇中的溶解度大于Y的氢化物,其原因是__________。
(3)X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为____________。
(4)X与Y形成的一种化合物的立方晶胞如图所示。
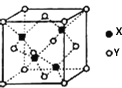
该化合物的化学式为_______,已知此晶体的密度为ρg·cm–3,阿伏伽德罗常数为NA,则此晶胞中X与Y的最近距离是______cm。(写出计算式,不要求计算结果。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据,试填写下列空白:
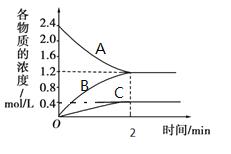
(1)该反应的化学方程式为__。
(2)从开始至2min,B的平均反应速率为__。
(3)下列叙述能说明该反应已达到化学平衡状态的是(填标号)__。
A.A、B、C的物质的量之比为3:1:3
B.相同时间内消耗3molA,同时生成3molC
C.相同时间内消耗3nmolA,同时消耗nmol的B
D.混合气体的总质量不随时间的变化而变化
E.B的体积分数不再发生变化
(4)在某一时刻采取下列措施能使该反应速率减小的是___。
A.加催化剂
B.降低温度
C.体积不变,充入A
D.体积不变,从容器中分离出A
(5)改变影响平衡的一个条件,5分钟后又建立了新平衡,发现C占平衡混合气的体积分数为![]() ,则反应物A的分解率为___。
,则反应物A的分解率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是生物体内四种有机物的组成与功能关系图,有关叙述不正确的是 ( )
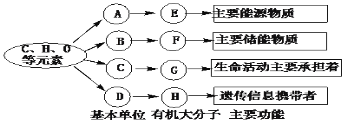
A. 玉米种子细胞中,物质A和E分别代表葡萄糖和纤维素
B. 相同质量的E和F彻底氧化分解,释放能量较多的是F
C. 在人体细胞中物质C约有20种
D. 不同的H在结构上的区别主要是碱基的排列顺序不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)是制备医药、炸药的一种重要原料,采用“亚硝酸甲酯-水合肼法”制备叠氮化钠的生产流程如下:
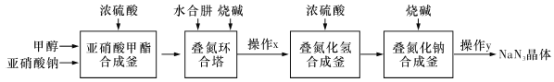
回答下列问题:
(1)亚硝酸甲酯合成釜中生成的亚硝酸甲酯(CH3ONO)易转化为气态进入叠氮环合塔,写出生成CH3ONO的化学反应方程式:_________________________________________________。
(2)叠氮环合塔中生成叠氮化钠的过程中生成一可循环使用的有机物,其官能团电子式为___________,该合成过程的化学方程式为______________________________________。
(3)已知氨基、氨气因有孤对电子而呈现一定碱性,所以水合肼(N2H4·H2O)的性质类似一水合氨,将硫酸与水合肼反应可以生成酸式盐,该盐的化学式为___________;叠氮环合塔中滴加的烧碱溶液要适当过量,目的主要是_________________________________。
A.促进NaN3水解 B抑制NaN3水解 C.作催化剂且对NaN3水解无影响
(4)生产中有HN3生成,请设计实验证明HN3为弱酸:________________________________。
(5)化工生产中,多余的NaN3常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理13 g NaN3,理论上需加入0.5 mol·L-1的NaClO溶液___________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】石棉的化学式可表示为3MgO·2SiO2·2H2O,具有高抗张强度、高挠性耐化学和热浸蚀、电绝缘及具有可纺性的硅酸盐类矿物产品。其中IIA族的元素属于碱土金属。回答下列问题:
(1)与Ca同周期的基态Fe原子的价电子排布式为___________。
(2)BeCl2易升华,液态时以双聚分子存在的BeCl2结构式为___________,其中Be的配位数为___________。
(3)化学式3MgO·2SiO2·2H2O中电负性最大的元素为__________。
SiO2的熔沸点远高于H2O,说明理由:____________________________________________。
(4)天然硅酸盐组成复杂,阴离子的基本结构单元是SiO44-四面体,如图(a),通过共用顶角氧离子可形成链状、网状等结构,图(b)为一种无限长双链的多硅酸根,其中O与Si的原子数之比为___________,化学式为___________。
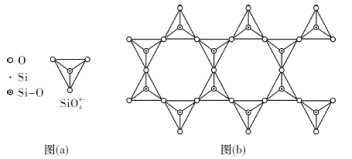
(5)经X射线分析鉴定,某一离子晶体属于立方晶系。晶胞顶点位置为Ti4+所占,体心位置为Ba2+所占,所有棱心位置为O2-所占,写出此晶体的化学式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为交警在对驾驶员是否饮酒进行检测。其原理是:K2Cr2O7酸性溶液遇呼出的乙醇蒸气迅速反应。下列对乙醇的描述与此测定原理有关的是( )

①乙醇沸点低
②乙醇密度比水小
③乙醇具有还原性
④乙醇是烃的含氧衍生物
⑤乙醇可与羧酸在浓硫酸的作用下发生取代反应
A.②⑤B.②③C.①③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )
A.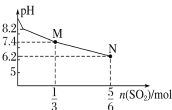 表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
表示用1 L 1 mol·L-1 Na2SO3溶液吸收SO2时溶液pH随SO2的物质的量的变化,则M点时溶液中:c(SO32-)>c(HSO3)
B.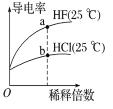 a点Kw的数值比b点Kw的数值大
a点Kw的数值比b点Kw的数值大
C.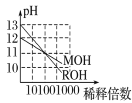 表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
表示MOH和ROH两种一元碱的溶液分别加水稀释时的pH变化,由图可得碱性:ROH>MOH
D.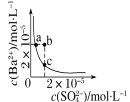 表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
表示某温度时,BaSO4在水中的沉淀溶解平衡曲线,则加入Na2SO4可以使溶液由a点变到b点
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com