
【题目】常温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生反应N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13 mol,nt(NH3)=6 mol,则a值为________。
(2)反应达到平衡时,混合气体的体积为716.8 L(标准状况下),其中氨气体积分数为25%,平衡时氨气的物质的量为________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同)n始∶n平=________。
(4)原气体中a∶b=________。
(5)达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=________。
(6)达到平衡时混合气体中,n(N2)∶n(H2)∶n(NH3)=________。
【答案】16 8 mol 5∶4 2∶3 1∶2 3∶3∶2
【解析】
(1)根据三段式计算;
(2)计算出混合气体总的物质的量,利用体积分数计算氨气的物质的量;
(3)利用差量法计算原混合气体的物质的量;
(4)原混合气体的物质的量减去氮气的物质的量为氢气的物质的量,据此计算;
(5)根据差量法计算出反应消耗的氮气和氢气的物质的量,计算出转化率;
(6)根据①②中数据计算出达到平衡时,反应混合物各组分的物质的量,据此计算。
(1)设反应转化的N2的物质的量为x,由题意可知:
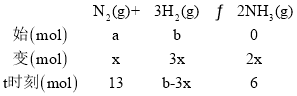
由2x=6得x=3,a=13+3=16;
(2)反应达平衡时,混合气体为![]() =32mol,其中NH3的物质的量为32mol×25%=8mol;
=32mol,其中NH3的物质的量为32mol×25%=8mol;
(3)设反应过程中混合气体总物质的量减少y,则
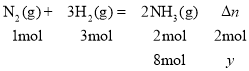
解得y=8 mol,原混合气体总物质的量为![]() +8 mol=40 mol,则n始∶n平=40 mol∶32 mol=5∶4;
+8 mol=40 mol,则n始∶n平=40 mol∶32 mol=5∶4;
(4)由(1)知a=16mol,则b=40mol16mol=24mol,所以:a∶b=16 mol∶24 mol=2∶3;
(5)平衡时,氮气的转化率为![]() ×100%=25%,氢气的转化率为
×100%=25%,氢气的转化率为![]() ×100%=50%,达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=1∶2。
×100%=50%,达到平衡时,N2和H2的转化率之比α(N2)∶α(H2)=1∶2。
(6)反应过程中各物质的物质的量如下:
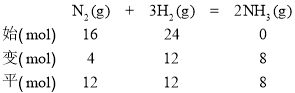
平衡混合气体中,n(N2)∶n(H2)∶n(NH3)=12 mol∶12 mol∶8 mol=3∶3∶2。


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)![]() 2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:
2CO(g)。平衡时,体系中气体体积分数与温度的关系如下图所示:

已知:气体分压(P分)=气体总压(P总)×体积分数。下列说法正确的是
A. 550℃时,若充入惰性气体,正,逆 均减小,平衡不移动
B. 650℃时,反应达平衡后CO2的转化率为25.0%
C. T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D. 925℃时,用平衡分压代替平衡浓度表示的化学平衡常数KP=24.0P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为800℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
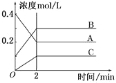
A.A是反应物
B.前2 min A的分解速率为0.1 mol·L-1·min-1
C.前2 min C的生成速率为0.2 mol·L-1·min-1
D.反应的方程式为:2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有丙炔和氢气的混合气体5L,在催化剂作用下,经充分反应后得到的气体的体积为V(所有体积均在同温同压下测定)。
(1)若将上述5L气体在氧气中完全燃烧生成二氧化碳和水,消耗同温同压下氧气的体积V(O2)为___(取值范围)。
(2)若氢气的体积为1L,反应后的体积V=___L。
(3)若氢气在混合气体中的体积分数为x,试用x表示反应后的体积V=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2AB+D在四种不同条件下进行,B、D起始浓度为零,A的浓度(molL-1)随反应时间(min)的变化情况如下表:
实验序号 | 时间 浓度 温度 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
下列说法正确的是
A.在实验1,反应在10至20分钟时间内物质A的平均速率为0.013mol/(Lmin)
B.在实验2,A的初始浓度c2>1.0molL-1
C.设实验3的反应速率为v3,实验1的反应速率为v1,则v3<v1
D.实验4中,该反应在30min后才达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水溶液X中只可能溶有Na+、Mg2+、Al3+、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种离子。某同学对该溶液进行了如下实验:
中的若干种离子。某同学对该溶液进行了如下实验:
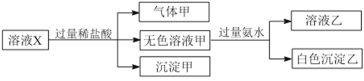
下列判断正确的是
A.气体甲一定是纯净物B.沉淀甲是硅酸和硅酸镁的混合物
C.Na+、![]() 和
和![]() 一定存在于溶液X中D.
一定存在于溶液X中D.![]() 和
和![]() 一定不存在于溶液X中
一定不存在于溶液X中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究含硫物质的循环,是能源开发和利用的重要途径之一。
(1)研究人员利用含硫物质热化学循环实现太阳能的转化与存储,过程如下:
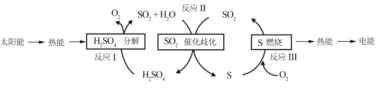
①反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJmol -1
反应Ⅲ:S(s)+O2(g) = SO2(g) ΔH3=-297 kJmol -1
反应Ⅱ的热化学方程式为________。
②对于反应Ⅱ,将投料比(n(SO2):n(H2O))为 3:2 的混合气体充入恒容的密闭容器中, 在不同压强下,H2SO4 在平衡体系中物质的量分数随温度的变化关系如下图所示。下列说法不正确的是___
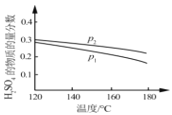
A.p2>p1,反应Ⅱ的ΔS < 0
B.使用合适催化剂可以提高 H2SO4 在平衡体系中物质的量分数
C.其他条件相同时,投料比(n(SO2):n(H2O))改变为 2:1,可提高 SO2 的平衡转化率
D.当容器内气体的密度不变时,可判断反应达到平衡状态
E.温度升高,有利于反应速率加快,SO2 的平衡转化率提高,K 值变小
(2)“硫碘循环”法是分解水制氢气的研究热点,涉及下列三个反应:
反应A:SO2(g) + I2(aq) + 2H2O(l) = 2HI(aq) + H2SO4(aq)
反应B:2HI(g) H2(g) + I2(g)
反应C:2H2SO4(g) 2H2O(g) + 2SO2(g) + O2(g)
①某温度下将 1mol HI 充入密闭容器中发生反应B,达到第 1 次平衡后,用选择性膜完全分离出 H2,达到第 2 次平衡后再次分离H2,重复多次,平衡时 n(HI)如下表:
达到平衡的次数 | 第 1 次 | 第 2 次 | 第 3 次 | 第 4 次 | 第 5 次 | …… |
n(HI)/mol | 0.78 | 0.67 | 0.60 | 0.55 | 0.51 | …… |
归纳出分离 H2 的次数对 HI 转化率的影响________。第 2 次平衡时 I2 的物质的量为 n(I2)=_____mol;
②反应 A 发生时,溶液中同时存在以下化学平衡: I2(aq) + I(aq)![]() (aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中
(aq),其反应速率极快且平衡常数很大。现将 1mol SO2 缓缓通入含 1 mol I2 的水溶液中恰好完全反应。请在下图中画出溶液中![]() 的物质的量 n( I3- )随反应时间 t 变化的曲线图____。
的物质的量 n( I3- )随反应时间 t 变化的曲线图____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“接触法制硫酸”的主要反应是2SO2+O2![]() 2SO3在催化剂表面的反应历程如下:
2SO3在催化剂表面的反应历程如下:
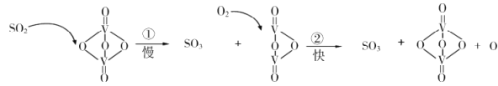
下列说法正确的是
A.使用催化剂只能加快正反应速率B.反应②的活化能比反应①大
C.该反应的催化剂是V2O4D.过程中既有V—O键的断裂,又有V—O键的形成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com