
【题目】如图,乙烯是重要的化工原料,以乙烯为原料在不同条件下可合成下列物质![]() 部分条件未标出
部分条件未标出![]() :
:
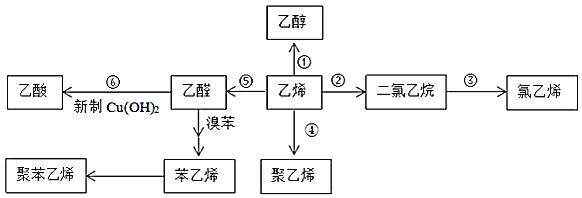
(1)乙醇能与乙酸反应生成有果香味的物质,其名称为______,该反应类型是______;
(2)反应![]() 的化学方程式是______,实验现象是______;
的化学方程式是______,实验现象是______;
(3)反应![]() 用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:______;
用KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:______;
(4)苯乙烯中所含官能团的名称______;
(5)苯乙烯合成聚苯乙烯的化学方程式是______;
(6)以乙醇和苯乙烯为原料合成有机物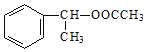 ,写出合成路线图______。
,写出合成路线图______。![]() 合成路线常用的表示方法为:A
合成路线常用的表示方法为:A![]() B目标产物
B目标产物![]() 目标产物
目标产物![]() 。
。
【答案】乙酸乙酯 酯化反应![]() 或取代反应
或取代反应![]() CH3CHO+2Cu(OH)2
CH3CHO+2Cu(OH)2![]() Cu2O↓+CH3COOH+2H2O 有砖红色沉淀生成 ClCH2CH2Cl+KOH
Cu2O↓+CH3COOH+2H2O 有砖红色沉淀生成 ClCH2CH2Cl+KOH![]() CH2=CHCl+H2O+KCl 碳碳双键
CH2=CHCl+H2O+KCl 碳碳双键  CH3CH2OH
CH3CH2OH![]() CH3CHO
CH3CHO![]() CH3COOH,
CH3COOH,
【解析】
反应①是乙烯与水发生加成反应生成乙醇,反应②是乙烯与氯气发生加成反应生成1,2-二氯乙烷,反应③是1,2-二氯乙烷发生消去反反应生成氯乙烯与HCl,反应④是乙烯发生加聚反应生成聚乙烯,反应⑤是乙烯与氧气在催化剂条件下发生氧化反应生成乙醛,反应⑥是乙醛与新制氢氧化铜发生氧化反应生成乙酸;苯乙烯发生加聚反应生成聚苯乙烯。
(6)![]() 可由CH3COOH和
可由CH3COOH和![]() 发生酯化反应得到,
发生酯化反应得到,![]() 可由
可由![]() 发生水解反应得到,
发生水解反应得到,![]() 可由
可由![]() 和HBr发生加成反应得到;CH3COOH可由CH3CHO发生氧化反应得到,CH3CHO可由CH3CH2OH发生氧化反应得到。
和HBr发生加成反应得到;CH3COOH可由CH3CHO发生氧化反应得到,CH3CHO可由CH3CH2OH发生氧化反应得到。
乙烯和水发生加成反应生成乙醇,所以①是加成反应;乙烯发生氧化反应生成乙醛,所以⑤是氧化反应;乙烯和氯气发生加成反应生成二氯乙烷,所以②是加成反应;二氯乙烷发生消去反应生成氯乙烯,则③为消去反应;乙烯发生加聚反应生成聚乙烯,则④为加聚反应;乙醛和新制氢氧化铜发生氧化反应生成乙酸,所以⑥是氧化反应;苯乙烯发生加聚反应生成聚苯乙烯,该反应为加聚反应;
(1)乙醇能与乙酸反应生成有果香味的物质,其名称为乙酸乙酯,该反应类型是酯化反应![]() 或取代反应
或取代反应![]() ,故答案为:乙酸乙酯;酯化反应
,故答案为:乙酸乙酯;酯化反应![]() 或取代反应
或取代反应![]() ;
;
(2)反应⑥的化学方程式是CH3CHO+2Cu(OH)2![]() Cu2O↓+CH3COOH+2H2O,实验现象是有砖红色沉淀生成,
Cu2O↓+CH3COOH+2H2O,实验现象是有砖红色沉淀生成,
故答案为:CH3CHO+2Cu(OH)2![]() Cu2O↓+CH3COOH+2H2O;有砖红色沉淀生成;
Cu2O↓+CH3COOH+2H2O;有砖红色沉淀生成;
(3)反应③用/span>KOH的乙醇溶液处理二氯乙烷制氯乙烯的方程式为:ClCH2CH2Cl+KOH![]() CH2=CHCl+H2O+KCl,
CH2=CHCl+H2O+KCl,
故答案为:ClCH2CH2Cl+KOH![]() CH2=CHCl+H2O+KCl;
CH2=CHCl+H2O+KCl;
(4)苯乙烯中所含官能团的名称碳碳双键,
故答案为:碳碳双键;
(5)苯乙烯合成聚苯乙烯的化学方程式是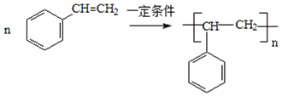 ,
,
故答案为: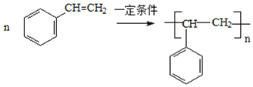 ;
;
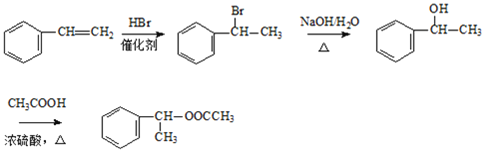
(6)乙醇和苯乙烯为原料合成有机物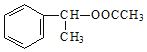 ,
,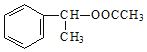 可由CH3COOH和
可由CH3COOH和![]() 发生酯化反应得到,
发生酯化反应得到,![]() 可由
可由![]() 发生水解反应得到,
发生水解反应得到,![]() 可由
可由![]() 和HBr发生加成反应得到,CH3COOH可由CH3CHO发生氧化反应得到,CH3CHO可由CH3CH2OH发生氧化反应得到,其合成路线为
和HBr发生加成反应得到,CH3COOH可由CH3CHO发生氧化反应得到,CH3CHO可由CH3CH2OH发生氧化反应得到,其合成路线为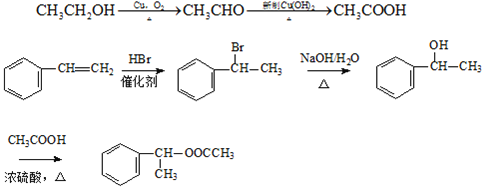 ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(III)([Co(NH3)6]Cl3)是合成其它含钴配合物的重要原料。制备流程如下:
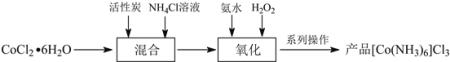
(1) “混合”步骤需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸的目的是______。
(2)流程中加入![]() 溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
溶液可防止加氨水时溶液中c(OH)过大,其原理是______。
(3)“氧化”步骤中应先加入氨水再加入![]() ,理由是______。
,理由是______。
(4)为测定产品中钴的含量,进行下列实验:
①称取样品4.000g于烧瓶中,加80mL水溶解,加入15.00mL 4molL-1NaOH溶液,加热至沸15~20min,冷却后加入15.00mL 6molL-1HCl溶液酸化,将![]() 转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
转化成Co3+,一段时间后,将烧瓶中的溶液全部转移至250.00mL容量瓶中,加水定容,取其中25.00 mL试样加入到锥形瓶中;
②加入足量KI晶体,充分反应;
③![]() 加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
加入淀粉溶液作指示剂,用0.1000molL-1Na2S2O3标准溶液滴定至终点,再重复2 次,测得消耗Na2S2O3溶液的平均体积为15.00mL。(已知:2Co3++2I=2Co2++I2,I2+2S2O32-=2I+S4O62-),通过计算确定该产品中钴的含量(写出计算过程)。______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,△H1=-393.5 kJmol-1,△H2=-395.4 kJmol-1,下列说法或表示式正确的是( )

A. C(s、石墨)==C(s、金刚石)△H=+1.9kJmol-1
B. 石墨和金刚石的转化是物理变化
C. 金刚石的稳定性强于石墨
D. 1 mol石墨的总键能比1 mol金刚石的总键能小1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如下转化关系:
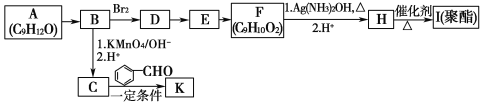
已知以下信息:
①A的苯环上只有一个支链,支链上只有两种不同化学环境的氢原子,且A能发生酯化反应;
②![]()
![]()
![]() +CO2;
+CO2;
③RCOCH3+R′CHO![]() RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)A生成B的反应类型为________,由E生成F的反应方程式为__________________
(2)K中含有两个六元环,则K的结构简式为_____________________。
(3)由F生成H的过程中第1步的化学方程式为_____________________。
(4)H有多种同分异构体,满足下列条件的有_________种,写出其中任意一种的结构简式:________。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③具有4组核磁共振氢谱峰
(5)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________________。
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件。__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.地下钢铁管道用导线连接锌块可以减缓管道的腐蚀
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.一定条件下,反应N2+3H2![]() 2NH3达到平衡时,3v正(H2)=2v逆(NH3)
2NH3达到平衡时,3v正(H2)=2v逆(NH3)
D.反应2NO(g)+2CO(g)===N2(g)+2CO2(g)常温下可自发进行,该反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关催化剂的催化机理等问题可从“乙醇催化氧化实验”得到一些认识.下图是某化学兴趣小组设计的乙醇催化氧化的实验装置。(提示:通常用新制的Cu(OH)2悬浊液产生砖红色沉淀来检验物质中含有醛基)。
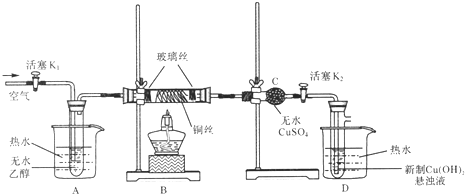
请据图回答以下问题:
(1)仪器连接安装完毕,进行实验前如何检验装置的气密性?答:_____________;
(2)对A中的乙醇采用水浴加热的目的是____________;
(3)实验时,点燃B处的酒精灯后,先____________,再集中火焰加热铜丝,随后向装置中不断地缓缓鼓入空气,此时B中观察到的现象是____________,发生的主要反应的化学方程式为____________,当反应进行一段时间后,移去酒精灯,继续不断缓缓地鼓入空气,B中仍重复如上现象,说明B处发生的反应是一个____________反应(填“吸热”或“放热”).
(4)装置C的作用是____________,能在此处观察到的现象是____________;
(5)装置D中的现象是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Cu(Ⅱ)盐晶体组成可表示为Ka[Cub(C2O4)c]·dH2O,为测定其组成,实验如下:
(1)溶液的配制
准确称取3.540 g样品,加入1mol·L-1H2SO4溶解,配制成100mL溶液。所需要的玻璃仪器有量筒、烧杯、胶头滴管、____、______。
(2)铜含量的测定
取所配溶液25.00mL于锥形瓶中,加入过量淀粉—KI溶液,充分反应后,生成的I2与12.50mL0.2000mol·L-1Na2S2O3恰好完全反应。已知:2Cu2++4I-=2CuI↓+I2,I2+2S2O32—= 2I-+S4O62—。判断生成的I2与Na2S2O3恰好完全反应的现象为______。3.540 g样品中n(Cu2+)=_____mol。
(3)草酸根含量的测定
取另一份所配溶液25.00mL于锥形瓶中,滴入0.1000 mol·L-1KMnO4溶液至恰好完全反应,消耗20.00 mL KMnO4溶液。已知:2MnO4—+5C2O42—+16H+=2Mn2++8H2O+10CO2↑,所配溶液中c(C2O42—)=____mol·L-1。
(4)计算该铜盐的组成(写出计算过程)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1
C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1。则CO还原Fe2O3(s)的热化学方程式为_________________________________________________。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式:__________________________________________________。
(3)①CO2和H2充入一定体积的密闭容器中,在两种温度下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如图。①曲线I、Ⅱ对应的平衡常数大小关系为KⅠ___________________KⅡ(填“>”或“=”或“<”)。
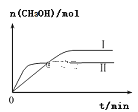
②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为______________________。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是______________。
a.容器中压强不变 b.H2的体积分数不变 c.c(H2)=3c(CH3OH)
d.容器中密度不变 e.2个C=O断裂的同时有3个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g)![]() CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如图,若温度不变,提高投料比n(H2)/n(CO2),则K将__________;该反应△H_________0(填“>”、“<”或“=”)。
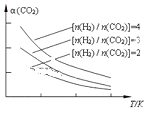
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是( )
A.无色透明的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
B.![]() =1×10-12的溶液中:K+、
=1×10-12的溶液中:K+、![]() 、
、![]() 、
、![]()
C.![]() 的溶液中:
的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
D.能使甲基橙变红的溶液中:![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com