解:由反应4FeS
2+11O
2 
2Fe
2O
3+8SO
2知A、D为Fe
2O
3、SO
2中的一种,结合A+O
2 →B知,A为SO
2,M为Fe
2O
3,B为SO
3,C为H
2SO
4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al
2O
3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO
2,J为HNO
3,E为NO;又由L+HNO
3 →D+NO↑分析知L为Fe,H为Al
2O
3;J应为Fe(NO
3)
3或Fe(NO
3)
2;联系反应④:D+H
2SO
4 →F+NO↑知,D为Fe(NO
3)
2;F为Fe(NO
3)
3或Fe
2(SO
4)
3;G应为Fe(OH)
3,则
(1)G为Fe,故答案为:Fe;
(2)在反应中②化合反应又是氧化还原反应、③为化合反应非氧化还原反应、⑥分解反应非氧化还原反应、⑨氧化还原反应,②③⑥⑨中既属于化合反应又属于非氧化还原反应的是③,故答案为:③;
(3)反应⑩是铁和硝酸发生反应生成硝酸亚铁、一氧化氮和水,反应的离子方程式是:3Fe+2 NO
3-+8H
++=3Fe
2++2NO↑+4H
2O,故答案为:3Fe+2 NO
3-+8H
++=3Fe
2++2NO↑+4H
2O;
(4)反应④硝酸亚铁在硫酸溶液中发生的氧化还原反应,离子方程式为:3Fe
2++NO
3-+4H
++=3Fe
3++NO↑+2H
2O,故答案为:3Fe
2++NO
3-+4H
++=3Fe
3++NO↑+2H
2O;
(5)将化合物D(Fe
2O
3) 与KNO
3、KOH 共融,可制得一种“绿色”环保高效净水剂K
2FeO
4 (高铁酸钾).同时还生成KNO
2和H
2O,依据化学方程式的书写原则,原子守恒,氧化还原反应的化合价升降总数相同,配平得到化学方程式为:Fe
2O
3+3KNO
3+4KOH

2K
2FeO
4+3KNO
2+2H
2O,故答案为:Fe
2O
3+3KNO
3+4KOH

2K
2FeO
4+3KNO
2+2H
2O;
(6)现有1molN参加反应,假设各步反应均完全,生成C(H
2SO
4)的质量为490g,生成G(Fe)的质量为224g,依据元素守恒,硫元素和铁元素物质的量为N中的元素,计算得到n(S)=
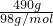
=5mol,n(Fe)=
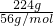
=4mol;则反应①的化学方程式为:Fe
4S
5+8O
2
2Fe
2O
3+5SO
2,故答案为:Fe
4S
5+8O
2
2Fe
2O
3+5SO
2.
分析:I是由第三周期元素组成的单质中熔点最高的金属为Al,依据(5)中可知含铁元素,结合F+NaOH生成E为氢氧化物推断F为三价铁的化合物,D为氧化铁Fe
2O
3;K是一种红棕色气体为NO
2.判断L为NO;J溶液为HNO
3;推断G为Fe;H为Al
2O
3,转化关系中①反应生成的A为非金属氧化物,结合N中只含有两种元素,N可作为工业生产C的原料,推断N为铁元素和硫元素组成的化合物;A为SO
2;B为SO
3;C为H
2SO
4;C+M(硝酸铁盐)反应生成F(三价铁离子)和NO,说明发生了氧化还原反应,证明M为Fe(NO
3)
2;依据判断出的物质分析回答问题.
点评:本题考查了物质转化关系和物质性质的应用,本题涉及铁及其化合物,Al、HNO
3、H
2SO
4、NO
x等内容,综合考查考生熟练运用元素化合物知识解决问题的能力,题目难度中等.


 2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则
2Fe2O3+8SO2知A、D为Fe2O3、SO2中的一种,结合A+O2 →B知,A为SO2,M为Fe2O3,B为SO3,C为H2SO4;由N为第三周期中熔点最高的金属知N为Al;L、H为Al2O3和Fe中的一种;由K是形成光化学烟雾及形成酸雨的一种主要气体知K为NO2,J为HNO3,E为NO;又由L+HNO3 →D+NO↑分析知L为Fe,H为Al2O3;J应为Fe(NO3)3或Fe(NO3)2;联系反应④:D+H2SO4 →F+NO↑知,D为Fe(NO3)2;F为Fe(NO3)3或Fe2(SO4)3;G应为Fe(OH)3,则 2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH
2K2FeO4+3KNO2+2H2O,故答案为:Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O;
2K2FeO4+3KNO2+2H2O;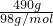 =5mol,n(Fe)=
=5mol,n(Fe)=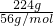 =4mol;则反应①的化学方程式为:Fe4S5+8O2
=4mol;则反应①的化学方程式为:Fe4S5+8O2 2Fe2O3+5SO2,故答案为:Fe4S5+8O2
2Fe2O3+5SO2,故答案为:Fe4S5+8O2 2Fe2O3+5SO2.
2Fe2O3+5SO2.

 名校课堂系列答案
名校课堂系列答案