
分析 依据氯化铝为强酸弱碱盐,水解呈酸性,存在水解平衡,结合盐类水解平衡移动影响因素解答;
解答 解:氯化铝为强酸弱碱盐,存在水解平衡,水解的离子方程式:Al3++3H2O?Al(OH)3+3H+,水解使溶液呈酸性,加入碳酸钙粉末,碳酸钙能够与氢离子反应,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,所以会产生大量二氧化碳气体;
反应后溶液中含有大量的钙离子,氢氧化钠与氢氧化铝反应生成偏铝酸钠,偏铝酸根离子与钙离子反应生成偏铝酸钙沉淀,所以在上述混合物中加入氢氧化钠溶液,未见氢氧化铝有明显的溶解现象;
故答案为:氯化铝为强酸弱碱盐,存在水解平衡,水解的离子方程式:Al3++3H2O?Al(OH)3+3H+,水解使溶液呈酸性,加入碳酸钙粉末,碳酸钙能够与氢离子反应,离子方程式:CaCO3+2H+=CO2↑+H2O+Ca2+,所以会产生大量二氧化碳气体;
氢氧化钠与氢氧化铝反应生成偏铝酸钠,偏铝酸根离子与钙离子反应生成偏铝酸钙沉淀.
点评 本题考查了盐类的水解,明确铝离子水解的方程式的书写及盐类水解平衡移动原理是解题关键,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:高中化学 来源: 题型:选择题
| A. | CuCl2溶液与Fe的反应:Cu2++Fe═Fe3++Cu | |
| B. | 向硫酸氢钠溶液中加入少量氢氧化钡溶液:Ba2++SO42-═BaSO4↓ | |
| C. | 向碳酸钙固体中加入稀盐酸:CO32-+2 H+═CO2↑+H2O | |
| D. | 向碳酸钠溶液中加入澄清的石灰水:Ca2++CO32-═CaCO3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
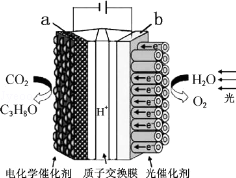 某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a极区向b极区迁移 | |
| C. | 每生成3mol O2,有88gCO2被还原 | |
| D. | a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 从试剂瓶中取出的一些Na2CO3溶液放入试管中,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中 | |
| B. | 稀释浓硫酸时,应将浓硫酸倒入水中,边加边搅拌 | |
| C. | 用蒸发方法使NaCl从溶液里析出,应将蒸发皿中NaCl溶液全部蒸干才停止加热 | |
| D. | 分液操作中,分液漏斗中下层液体从下口放出,上层液体也从下口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )
X气体为SO2和CO2的混合气体,Y气体为Cl2,它们同时通入盛有足量氯化钡溶液的洗气瓶中(如下图所示装置).下列说法正确的是( )| A. | 洗气瓶中产生的沉淀是亚硫酸钡 | B. | 洗气瓶中产生的沉淀是碳酸钡 | ||
| C. | 洗气瓶中没有明显现象 | D. | 洗气瓶中有硫酸钡沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2中阴、阳离子的个数比为1:1 | |
| B. | Na202比Na2O稳定,保存时可直接露置于空气中 | |
| C. | Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等 | |
| D. | Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A和B的平衡浓度之比为5:3 | B. | A和B的平衡浓度之比为2:3 | ||
| C. | x=1 | D. | x:y=2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 分类标准 | 碱性氧化物 | 碱 | 含氧酸 | 盐 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com