
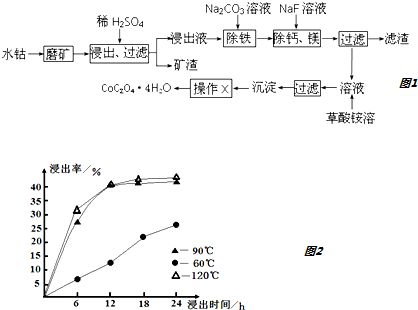
分析 水钴矿磨矿将矿石粉碎,增大接触面积,加快反应速率,加入稀硫酸,矿渣为SiO2,滤液中含有:CoSO4、Fe2(SO4)3、MgSO4、CaSO4,加入碳酸钠,除去Fe2(SO4)3,加入氟化钠,除去钙镁,过滤得主要含CoSO4的溶液,加入草酸铵,通过沉淀、过滤、洗涤、干燥得到四水合草酸钴,
(1)根据浸出率与时间和温度的关系及生产成本分析;
(2)CoO溶解于酸生成盐和水,分析可知矿渣为不溶于硫酸的二氧化硅和硫酸钙;
(3)根据原子守恒配平方程式;
(4)依据离子浓度之比变式得到:$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$;
(5)根据流程图中加入的物质分析,该沉淀中吸附易溶于水的离子;得到的沉淀要进行洗涤和干燥,才能得到较纯净、干燥的物质;
(6)依据钴元素守恒计算得到;
解答 解:(1)根据图知,时间越长浸出率越高,温度越高,浸出率越高,但浸出12小时后,浸出率变化不大,90℃和120℃浸出率变化不大,且时间过长、温度过高导致成本较大,所以最佳的浸出时间为12小时,最佳的浸出温度为90℃,故答案为:12;90;
(2)水钴矿中除SiO2外还有9.24%CoO,2.78%Fe2O3,0.96%MgO、0.084%CaO,加入硫酸溶解的是氧化铁、氧化镁、氧化钙、氧化钴,氧化钴溶解于硫酸反应的离子方程式为:CoO+2H+=Co2++H2O,二氧化硅不溶,生成的硫酸钙微溶,所以残渣为SiO2、CaSO4,
故答案为:CoO+2H+=Co2++H2O;SiO2、CaSO4;
(3)根据原子守恒配平方程式,所以其方程式为:3Fe2(SO4)3+6H2O+6Na2CO3=Na2Fe6 (SO4)4(OH)12↓+5Na2SO4+6CO2↑,
故答案为:3,6,6,1,5,6;
(4)离子浓度之比变式得到:$\frac{c(M{g}^{2+})}{c(C{a}^{2+})}$=$\frac{Ksp(Mg{F}_{2})}{Ksp(Ca{F}_{2})}$=$\frac{7.4×1{0}^{-11}}{1.0×1{0}^{-10}}$=0.74,
故答案为:0.74;
(5)该沉淀中吸附易溶于水的离子,根据流程图知,溶液中含有硫酸根离子、铵根离子和钠离子,所以沉淀上含有硫酸根离子、铵根离子和钠离子,得到的沉淀要进行洗涤和干燥才能得到较纯净、干燥的物质,取最后一次洗涤液于试管中,向其中滴加适量的BaCl2溶液,若无白色沉淀生成什么洗涤干净,
故答案为:取最后一次洗涤液于试管中,向其中滴加适量的BaCl2溶液,若无白色沉淀生成什么洗涤干净;
(6)水钴矿中有9.24%CoO,则10t水钴矿中CoO质量=10t×9,24%=0.924t,依据钴元素守恒价,
CoO~~CoC2O4•4H2O
75 219
0.924t m
m=2.70t,
故答案为:2.7;
点评 本题考查难溶电解质的溶解平衡、电极反应式的书写、物质的分离和提纯等知识点,难点是(3)题,明确溶度积常数的含义是解此题关键,电极反应式的书写是学习难点,要结合电解质溶液的酸碱性书写,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn是正极,Ag2O是负极 | B. | 负极反应为Zn+2OH--2e-=Zn(OH)2 | ||
| C. | 工作时负极区溶液的pH增大 | D. | 工作时溶液中K+移向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
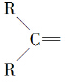 ”生成酮,“
”生成酮,“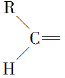 ”生成“
”生成“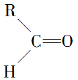 ”,
”,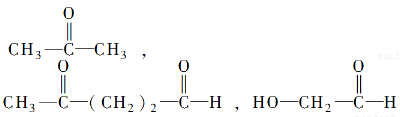
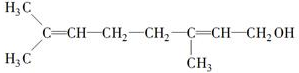 或
或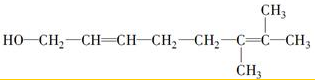 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
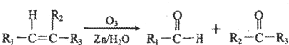
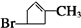
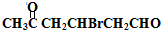 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$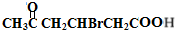 +Cu2O↓+2H2O
+Cu2O↓+2H2O .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com