
【题目】下列表述中正确的是
A. 任何能使熵值增大的过程都能自发进行
B. △H<0,△S>0的化学反应一定能自发进行
C. 已知热化学方程式2SO2(g)+O2(g)![]() 2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
2SO3(g)△H=-QkJ·mol-1(Q>0),则将2mol SO2(g) 和1mol O2(g) 置于一密闭容器中充分反应后放出Q kJ的热量
D. 稀溶液中1mol NaOH分别和1mol CH3COOH、1molHNO3反应,两者放出的热量一样多
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】氨为重要的化工原料,有广泛用途。
(1)合成氨中的氢气可由下列反应制取:
a.CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
CO(g)+3H2(g) ΔH1=+216.4 kJ·mol-1
b.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1
则反应CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) ΔH=_________________________。
CO2(g)+4H2(g) ΔH=_________________________。
(2)起始时投入氮气和氢气的物质的量分别为1 mol、3 mol,在不同温度和压强下合成氨。平衡时混合物中氨的体积分数与温度的关系如图。

①恒压时,反应一定达到平衡状态的标志是________(填序号)。
A N2和H2的转化率相等 B 反应体系密度保持不变
C c(H2)/c(NH3 )保持不变 D c(NH3 )/c(N2)=2
②p1________(填“>”、“<”、“=”或“不确定”,下同)p2;反应的平衡常数:B点________D点。
③C点H2的转化率为________;在A、B两点条件下,该反应从开始到平衡时生成氨气的平均速率:v(A)________v(B)。
(3)N2H4可作火箭推进剂,NH3和NaClO在一定条件下反应可生成N2H4。
①写出NH3和NaClO反应生成N2H4的化学方程式________________________________。
②已知25 ℃时,N2H4的水溶液呈弱碱性:N2H4+H2O![]() N2H5++OH-K1=1×10-a N2H5++H2O
N2H5++OH-K1=1×10-a N2H5++H2O![]() N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
N2H62++OH- K2=1×10-b25 ℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH的范围为__________________________________(用含a、b的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带中含有丰富的碘。为了从海带中提取碘,某研究性学习小组设计并进行了以下实验(苯,一种不溶于水,密度比水小的液体):

请回答下列问题:
(1)步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是________(填标号)。
A.烧杯 B.坩埚 C.表面皿 D.泥三角 E.酒精灯 F.干燥器
(2)步骤③的实验操作名称是________;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是________。
(3)步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是___________________。
在分液操作中,应充分振荡,然后静置,待分层后________(填标号)。
A.直接将含碘苯溶液从分液漏斗上口倒出
B.直接将含碘苯溶液从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将含碘苯溶液从下口放出
D.先将水层从分液漏斗的下口放出,再将含碘苯溶液从上口倒出
(4)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.⑴指出如下图实验装置中的错误之处(加热装置中烧杯底部已垫有石棉网)
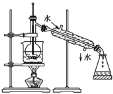
①____________________;
②____________________。
⑵图是某学生的过滤操作示意图,其操作不规范的是______

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
Ⅱ.海藻中提取碘的流程如图,已知②中发生反应的化学方程式为:Cl2+2KI=2KCl+I2。请回答下列问题:


⑴指出提取碘的过程中有关实验操作①和②的名称:__________;________。
⑵在3 mL含碘的水溶液中加入1mL四氯化碳,振荡静置后观察到试管里的分层现象是上图中的_____(注:试管中深色区为有色溶液),上层无色溶液的溶质是_____下层颜色是_____。
⑶从含碘的有机溶液中提取碘和回收有机溶剂,还需经过的操作是_______。
Ⅲ.某溶液中含有MgSO4和Na2SO4两种溶质,选择适当试剂将溶液中的镁离子转化为沉淀或固体分离出来,设计实验流程如下:

欲证明滤液中存在SO42-、OH-,选用的方案是先取少量的滤液滴加________,发现溶液变红,再向其中加入________溶液,出现白色沉淀,则可证明SO42-、OH-,均存在。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用电化学原理可同时将SO2、CO2变废为宝,装置如图所示(电极均为惰性电极)。下列说法不正确的是
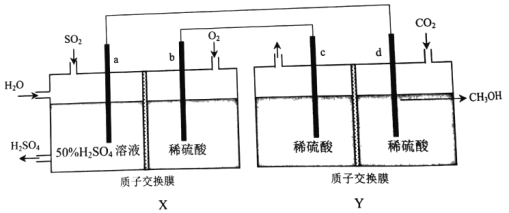
A. a为负极,发生氧化反应
B. 装置工作时,电子从c极流入b极
C. 若b极消耗16gO2,则Y中左侧溶液质量减轻16g
D. d电极反应式为CO2+6H++6e-=CH3OH+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
(1)基态Cu原子中,电子在核外排布的原子轨道共有________个。
(2)N、O、S元素的原子对键合电子吸引力最大的是_________。
(3)[Cu(NH3)4]2+中,提供孤对电子的是________。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是________(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是________。
(4)NH3中N原子的杂化方式是_________,乙醇分子中采用同样杂化方式的原子有_________________个。
(5)硫元素对应的含氧酸酸性是H2SO4强于H2SO3,其原因为_________。
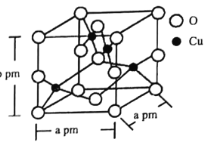
(6)铜的一种氧化物晶体结构如图所示,该氧化物的化学式是________。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA,则该氧化物的密度为_________g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g) ![]() 2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H < 0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率ν(Z)=2.0×10-3 mol·L-1·min-1
B. 其他条件不变,降低温度,反应达到新平衡前ν(逆)> ν(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,原子序数依次增大,A、E同主族,A元素的原子半径最小,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物对应的水化物X与其氢化物反应生成一种盐Y,A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物,E2D2可用于呼吸面具或潜水艇中氧气的来源。请根据以上信息回答下列问题:
(1)BD2的电子式为_______________________。
(2)EAB2D4水溶液显酸性的原因是____________________________________。
(3)将等浓度等体积的EBC溶液和ABC溶液混合,所得混合溶液(呈碱性)中各微粒(水分子除外)浓度由大到小的顺序为_________________________________________。
(4)A、B、D、E四种元素组成的某无机化合物,受热易分解。写出该化合物的溶液与足量的Ba(OH)2溶液反应的离子方程式__________________________________。
(5)常温下,测得X和Y的水溶液的pH均为5,则两种水溶液中由水电离出的H+浓度之比是_________。
(6)在一个装有可移动活塞的密闭容器中进行如下可逆反应:C2(g)+3A2(g)![]() 2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
2CA3(g)△H=-92.4 kJ/mol。反应达到平衡后,测得容器中各物质的物质的量分别为C2:0.5 mol、A2:0.2 mol、CA3:0.2 mol,此时容器体积为1.0 L。如果保持温度和压强不变,向上述平衡体系中加入0.18 molC2,平衡将______移动(填“正向”、“逆向”或“不”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
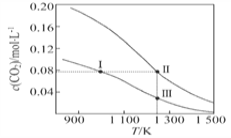
A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com