
| A. | pH小于7的雨水称为酸雨 | |
| B. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| C. | O3可用于游泳池的杀菌消毒 | |
| D. | 黄铜是纯铜,青铜是合金 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
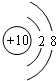
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1×10-7 mol/L | B. | 1×10-12mol/L | C. | 1×10-2 mol/L | D. | 1×10-7 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
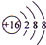
 2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色
2NH3,向X的水溶液中滴入酚酞溶液,会观察到溶液变红色查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.24L | B. | 3.36L | C. | 1.12L | D. | 4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
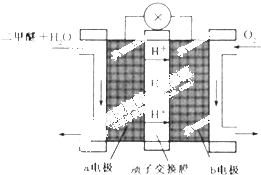 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com