
 CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol
CO是火力发电厂释放出的主要尾气,为减少对环境污染,发电厂试图采用CO与Cl2在催化剂的作用下合成光气(COCl2).某温度下,向2L的密闭容器中投入一定量的CO和Cl2,在催化剂的作用下发生反应:CO(g)+Cl2(g)?COCl2(g)△H=a kJ/mol| t/min | n (CO)/mol | n (Cl2)/mol |
| 0 | 1.20 | 0.60 |
| 1 | 0.90 | |
| 2 | 0.80 | |
| 4 | 0.20 |
分析 (1)根据v=$\frac{△c}{△t}$计算v(COCl2)比较大小;
(2)4min内,反应的氯气为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态;
由方程式可知,平衡时生成COCl2为0.4mol,平衡常数K=$\frac{c(COC{l}_{2})}{c(CO)c(C{l}_{2})}$;
(3)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应.
解答 解:(1)由表中数据,0-1min内,△n(CO)=1.2mol-0.9mol=0.3mol,由方程式可知△c(COCl2)=△c(CO)=0.3mol,则v(COCl2)=$\frac{\frac{0.3mol}{2L}}{1min}$=0.15mol/(L.min),0~2min内△n(CO)=1.2mol-0.8mol=0.4mol,由方程式可知△c(COCl2)=△c(CO)=0.4mol,则v(COCl2)=$\frac{\frac{0.4mol}{2L}}{2min}$0.1mol/(L.min),1min-2min内,△n(CO)=0.9mol-0.8mol=0.1mol,由方程式可知△c(COCl2)=△c(CO)=0.1mol,则v(COCl2))=△c(CO)=$\frac{\frac{0.1mol}{2L}}{1min}$=0.05mol/(L.min),v(0-1)>v(0-2);v(0-2)>v(1-2),
故答案为:>;>;
(2)4min内,反应的氯气为0.6mol-0.2mol=0.4mol,由方程式可知参加反应的CO为0.4mol,故4min时CO为1.2mol-0.4mol=0.8mol,与2min时CO的物质的量相等,则2min、4min处于平衡状态,在2min~4min间,v(Cl2)正 =v(Cl2)逆,
由方程式可知,平衡时生成COCl2为0.4mol,该温度下平衡常数K=$\frac{c(COC{l}_{2})}{c(CO)c(C{l}_{2})}$=$\frac{\frac{0.4}{2}}{\frac{0.8}{2}×\frac{0.2}{2}}$=5,
故答案为:=;5;
(3)正反应为气体体积减小的反应,增大压强平衡正向移动,CO转化率增大,而图中随X增大时,CO的平衡转化率降低,平衡逆向移动,则X为温度,正反应为放热反应,故a<0,
故答案为:温度;<;因为X增大时,CO的平衡转化率降低,平衡逆向移动.
点评 本题考查化学平衡计算与影响因素、反应速率、平衡常数、化学平衡图象等,注意对基础知识的理解掌握,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L-1 | 1.00 | 0.8 | 0.64 | 0.55 | 0.5 | 0.5 |
| c(CO)/mol•L-1 | 3.50 | 3.30 | 3.14 | 3.05 | 3.00 | 3.00 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲溶液含有OH- | B. | 乙溶液含有SO42- | C. | 丙溶液含有Cl- | D. | 丁溶液含有Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | T1<T2,Q>0 | |
| B. | 增大压强,B的转化率减小 | |
| C. | 当混合气体的密度不再变化,反应达平衡状态 | |
| D. | a+b<c+d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用A表示的反应速率是0.4 mol•L-1•min-1 | |
| B. | 分别用B、C、D表示的反应速率之比是3:2:1 | |
| C. | 在2 min末的反应速率,用B表示是0.3 mol•L-1•min-1 | |
| D. | 在2 min内的反应速率,用C表示是0.3 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
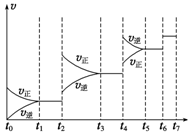 研究NO2、SO2、CO等大气污染气体的处理具有重要意义.
研究NO2、SO2、CO等大气污染气体的处理具有重要意义.| t1~t2 | t3~t4 | t5~t6 | t6~t7 |
| K1 | K2 | K3 | K4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸与水能以任意比互溶 | B. | 醋酸溶液能导电 | ||
| C. | 醋酸溶液中存在醋酸分子 | D. | 醋酸能和碳酸钙反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质燃烧都是吸热反应 | B. | 化学反应总是伴随着能量的变化 | ||
| C. | 需要加热的反应一定是吸热反应 | D. | 化学反应中放出的热量就是反应热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com