
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:






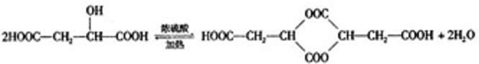
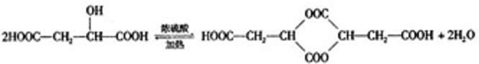
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:
Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A 9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
| 盐酸体积(mL) | 8 | 15 | 20 | 50 | x | 120 | 150 |
| 生成CO2体积(mL) | 0 | 112 | 224 | 896 | 2240 | 2240 | 2240 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com