
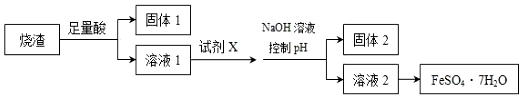
| A. | 溶解烧渣选用足量硫酸,试剂 X 选用铁粉 | |
| B. | 固体1 中一定含有 SiO2,控制 pH 是为了使 Al3+转化为 Al(OH)3,进入固体 2 | |
| C. | 从溶液 2 得到 FeSO4•7H2O 产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液 1 中直接加 NaOH 至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到 FeSO4•7H2O |
分析 硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其它杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,以此进行解答.
解答 解:硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质),混合物中加入足量硫酸,Fe2O3、Al2O3与酸反应生成的硫酸铁、硫酸铝,二氧化硅不反应,过滤,固体1为二氧化硅;在滤液中加入铁粉将铁离子还原为亚铁离子,调节pH值使铝离子完全生成氢氧化铝沉淀,过滤,固体2为氢氧化铝,溶液2为硫酸亚铁,蒸发浓缩、冷却结晶、过滤,得到硫酸亚铁晶体,
A.由流程分析可知,溶解烧渣选用足量硫酸,X为铁粉,故A正确;
B.由流程分析可知,固体1中一定含有SiO2,调节pH值使铝离子完全生成氢氧化铝沉淀,则固体2为氢氧化铝,故B正确;
C.亚铁离子易被空气中的氧气氧化,而且受热易失去结晶水,所以从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解,故C正确;
D.在溶液1中含有铁离子和铝离子,加过量的氢氧化钠,铝离子转化为偏铝酸根离子,铁离子与氢氧根离子结合生成氢氧化铁沉淀,所以最终得到的是硫酸铁而不是硫酸亚铁,故D错误.
故选D.
点评 本题考查制备实验方案的设计与评价、工艺流程的分析应用,题目难度中等,侧重学生分析能力和创新能力的培养,注意把握常见物质的分离方法.


科目:高中化学 来源: 题型:选择题
| A. | 可用细铁丝代替铂丝做焰色反应实验 | |
| B. | 容量瓶使用前须烘干 | |
| C. | 可用CCl4将溴水中的溴单质分离除净 | |
| D. | 用元素分析仪确定物质中含有哪些金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂 | B. | 扩大容器体积 | C. | 升高温度 | D. | 增大压强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  观察Fe(OH)2的生成 | |
| B. | 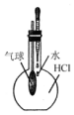 用图所示方法验证HCl气体易溶于水 | |
| C. | 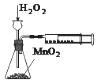 用图定量测定H2O2的分解速率 | |
| D. | 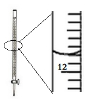 记录滴定终点读数为12.20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaCl | B. | Ba(OH)2 | C. | NH4Al(SO4)2 | D. | Na3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极的电极反应式为 Li-e-=Li+ | |
| B. | 正极的电极反应式为2SOCl2+4e-=SO2+S+4Cl- | |
| C. | 若电解液中含有水,则该电池的效率将大大降低 | |
| D. | 若负极有14gLi参加反应,则理论上流过电路中的电子书约为1.204×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气通入石灰乳中,制取漂白粉 | |
| B. | 自来水厂可用明矾对水进行消毒杀菌 | |
| C. | 实验室保存氯化铁溶液时加少量盐酸,目的是防止Fe3+水解 | |
| D. | 常温下浓硝酸与铝、铁均不反应,可用铝或铁制的容器存放浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | ||
| 铝 | X | 硫 | Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com