
【题目】一种利用水钴矿[主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等]制取CoCl2·6H2O的工艺流程如下:
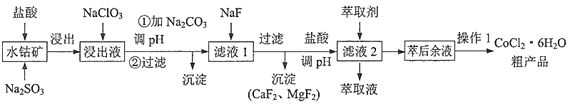
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Al3+、Mn2+、Ca2+、Mg2+等
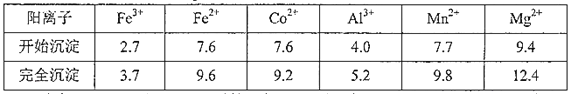
②部分阳离子开始沉淀和完全沉淀的pH见下表
③CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定,加热至110~120℃时失去结晶水变成无水氯化钴。
(1)写出Co2O3与Na2SO3和盐酸反应的离子方程式______________________。
(2)加入NaClO3的目的是______________________;加入过量NaClO3可能生成有毒气体,该气体是___________(填化学式)
(3)为了除去Fe3+、Al3+,需加Na2CO3调pH,则pH应控制的范围为_____________________.
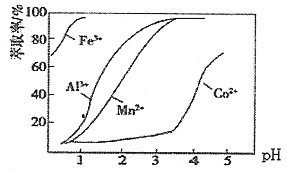
(4)加萃取剂的目的是___________;金属离子在萃取剂中的萃取率与pH的关系如图,据此分析pH的最佳范图为___________(填字母序号)。
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(5)CoCl2·6H2O常用减压烘干法烘干,原因是___________。
【答案】Co2O3+SO32-+4H+=2Co2++SO42-+2H2O 将Fe2+氧化成Fe3+ Cl2 5.2![]() pH<7.6 除去溶液中的Mn2+ B 降低烘干温度,防止产品熔化或分解失去结晶水变为无水氯化钴
pH<7.6 除去溶液中的Mn2+ B 降低烘干温度,防止产品熔化或分解失去结晶水变为无水氯化钴
【解析】
含钴废料中加入盐酸和亚硫酸钠,可得CoCl2、AlCl3、FeCl2、MnCl2,加入NaClO3,可得到FeCl3,然后加入Na2CO3调pH至5.2,可得到Fe(OH)3、Al(OH)3沉淀,过滤后所得滤液主要含有CoCl2,为得到CoCl26H2O晶体,应控制温度在86℃以下蒸发,加热时要防止温度过高而失去结晶水,可减压烘干。
(1)水钴矿的主要成分为Co2O3,加入盐酸和亚硫酸钠,浸出液含有Co2+,所以Co2O3和亚硫酸钠在酸性条件下发生氧化还原,根据电荷守恒和得失电子守恒,反应的离子方程式为:Co2O3+SO32-+4H+=2Co2++SO42-+2H2O;
(2)NaClO3的作用是将Fe2+氧化成Fe3+,其反应的离子方程式为:ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;在酸性条件下,过量NaClO3与氯离子发生氧化还原反应生成氯气;
(3)Fe3+完全水解的pH为3.7,Al3+完全水解的pH为5.2,Co2+开始水解的PH为7.6,所以为了除去Fe3+、Al3+,加入Na2CO3调pH应控制的范围为5.2![]() pH<7.6;
pH<7.6;
(4)根据流程图可知,存在Mn2+、Co2+金属离子的溶液中,加入萃取剂的目的是除去溶液中的Mn2+;由萃取剂对金属离子的萃取率与pH的关系可知,调节溶液PH在3.0~3.5之间,故选B;
(5)根据题意知,CoCl26H2O常温下稳定无毒,加热至110~120℃时,失去结晶水变成有毒的无水氯化钴,为防止其分解,制得的CoCl26H2O需减压烘干。


科目:高中化学 来源: 题型:
【题目】(1)写出以下反应的化学反应方程式
①三氧化二铁与稀硫酸反应:______
②氢氧化铝药物治疗胃酸(主要成分为盐酸)过多:______
③氢氧化钠溶液吸收少量二氧化硫气体:______
(2)已知CO和CO2的混合气体18.0g在标准状况下所占的体积为11.2L。则该混合气体中,CO2的物质的量为____mol。
(3)在同温同压下,若A容器中的O2和B容器中的SO2所含的氧原子总数相等,则A容器和B容器的体积比是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 0.3mol·L-1A1(NO3)3溶液中含A13+数小于0.3NA
B. H2(g)+I2(g)![]() 2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
2HI(g) △H=-akJ·mol-1,若向某密闭容器中加入NA个氢分子和NA个碘分子,则充分反应后放出的热量为akJ
C. 标准状况下,(-)Zn│H2SO4(1mol·L-1)│Cu(+)原电池中,当正极产生1.12LH2时,则外电路中通过的电子数为0.1NA
D. 常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
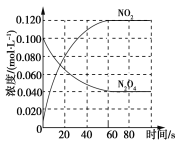
回答下列问题:
(1)反应的△H_______0(填“大于”或“小于”) ;100℃时,体系中各物质浓度随时间变化如上图所示。在0-60s时段,反应速率v(N2O4)为______mol·L-1·s-1;反应的平衡常数K1为________。
(2)100℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020mol·L-1·s-1的平均速率降低,经10s又达到平衡。
a:T______100℃ (填“大于”或“小于”),判断理是_______________________________
b:温度T时反应的平衡常数K2为__________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向______(填“正反应”或“逆反应”)方向移动,判断理由是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mL浓度均为0.10mol/L的XOH和X2CO3溶液分别加水稀释(溶液体积为V),溶液pH随lgV的变化情况如图所示,则下列说法正确的是

A. XOH是弱碱
B. pH=10的溶液中c(X+):XOH大于X2CO3
C. 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2
D. 当lgV=2时,升高X2CO3溶液温度,溶液碱性增强且c(HCO3-)/c(CO32-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几组物质:
①苯和乙苯②CH3COOH和![]() ③CH3CH2CH2CH3和
③CH3CH2CH2CH3和![]()
④ CH3CH2C≡CH和CH3C≡CCH3⑤CH2=CHCH2CH3和![]() ⑥
⑥![]() 和
和![]()
(1)属于同系物的是_______(填序号,下同);
(2)属于同一物质的是_______;
(3)由于碳骨架不同而产生的同分异构体是_______ ;
(4)由于官能团的位置不同而产生的同分异构体是_______;
(5)具有不同官能团的同分异构体是 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知岩脑砂的主要成分为NH4Cl,实验室可通过过量氨气和氯气反应制NH4Cl。
I.实验室制NH4Cl

(1)写出B中反应的离子方程式_________________________________。
(2)为使氨气和氯气在D中充分混合并反应,上述装置的连接顺序为a→d→c_____、______←j←i←h←g←b;写出D中反应的化学方程式_________________________________。
(3)若要检验NH4Cl,除蒸馏水、稀HNO3、AgNO3溶液、红色石蕊试纸外还需要的试剂为___________。
Ⅱ:天然岩脑砂中NH4Cl,纯度的测定(杂质不影响NH4Cl纯度测定)
已知:2NH4 C1+3CuO![]() 3Cu+2HC1↑+N2↑+3H2O
3Cu+2HC1↑+N2↑+3H2O
实验步骤:①准确称取1.19g岩脑砂。②将岩脑砂与足量氧化铜混合加热(装置如下)。
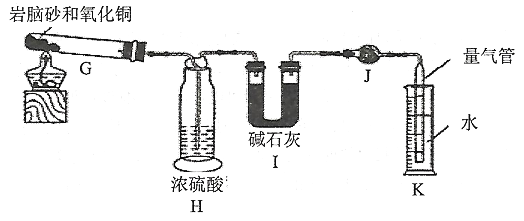
(1)连接仪器,检查装置气密性:先将K中装入水,然后加热G,______________________,则气密性良好。
(2)H中浓硫酸的作用是_________________________________。
(3)实验结束后,恢复至原温,通过K测得气体体积为224mL(换算为标准状况),则天然岩脑砂中NH4C1的纯度为___________。(保留三位有效数字)
(4)某同学通过测I的增重来计算天然岩脑砂中NH4C1的质量分数,则所得NH4C1的纯度___________。(填“偏高”、“偏低”、“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铜能被FeCl3的浓溶液腐蚀,其化学方程式是:Cu+2FeCl3=CuCl2+2FeCl2。
现将有铜的印刷线路板浸入120mL FeCl3的溶液中,有9.6 g铜被腐蚀掉。取出印刷线路板,向溶液中加入8.4g铁粉,经充分反应,溶液中还存在4.8g不溶物。(设溶液体积不变,且不考虑金属离子水解)。
(1)根据9.6g铜被腐蚀,最后溶液中还有4.8g不溶物,说明溶液中肯定还有_____,所以4.8g固体不可能有____,即4.8g是_______。
(2)9.6 g铜被腐蚀生成________ mol Fe2+。
(3)最后溶液中金属离子物质的量浓度c(Cu2+)=______,c(Fe2+)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
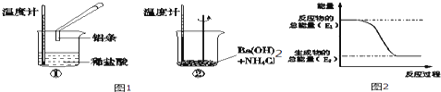
(1)某实验小组同学进行如下实验,以检验化学反应中的能量变化,实验中发现,反应后①中的温度升高;②中的温度降低.由此判断铝条与盐酸的反应是___________热反应,Ba(OH)28H2O与NH4Cl的反应是________________________热反应.反应过程___________________________(填“①”或“②”)的能量变化可用图2表示.
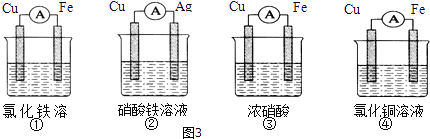
(2)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的是_________(填序号).
(3)将CH4设计成燃料电池,其利用率更高,装置如图4所示(a、b为多孔碳棒)处电极入口通甲烷(填A或B),其电极反应式为_____________________ .
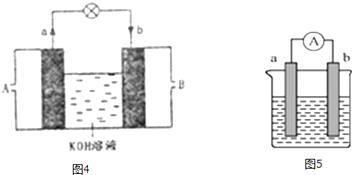
(4)如图5是某化学兴趣小组探究不同条件下化学能转变为电能的装置.请回答下列问题:
①当电极a为Al、电极b为Cu、电解质溶液为稀硫酸时,写出该原电池正极的电极反应式为___________________________ .
②当电极a为Al、电极b为Mg、电解质溶液为氢氧化钠溶液时,该原电池的正极为_______;该原电池的负极反应式为_____________________________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com