
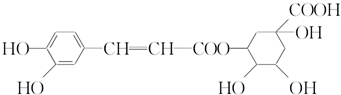
| A. | 分子式为C16H18O9 | |
| B. | 0.1 mol绿原酸最多与0.8 mol NaOH反应 | |
| C. | 能与Na2CO3反应 | |
| D. | 能发生取代反应和消去反应 |
分析 该有机物中含酚-OH、C=C、醇-OH、-COOH、-COOC及苯环等,结合醇、羧酸、酚的性质来解答.
解答 解:A.由结构简式可知,分子式为C16H18O9,故A正确;
B.酚-OH、-COOH、-COOC-能与NaOH溶液反应,则0.1mol绿原酸最多与0.4molNaOH反应,故B错误;
C.含酚-OH、-COOH,均能与Na2CO3反应,故C正确;
D.含醇-OH,且与-OH相连的邻位碳上含H,则能发生消去反应,酚-OH、醇-OH、-COOH,均可发生取代反应,故D正确.
故选B.
点评 本题考查有机物的结构与性质,注意把握有机物的官能团与性质的关系,熟悉酚、醇、羧酸的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温下,7.8g固体Na2O2中,含有的阴阳离子总数为0.4NA | |
| B. | 常温常压下,17g烃基含有的电子总数为9N | |
| C. | 标准状况下,11.2LCH2CI2中含有的共价键数目为2N. | |
| D. | CH2=CH2和CH2=CHCH3的混合气体28g,完全燃烧后生成的CO2分子数目为2.5N |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
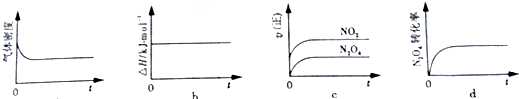
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
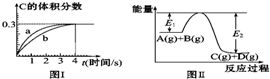
| A. | 该温度下,反应的平衡常数数值约为7.36 | |
| B. | 恒温条件下,缩小反应容器体积可以使反应的过程按图Ⅰ中a曲线进行 | |
| C. | 反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是:0.225 mol•L-1•s-1 | |
| D. | 在上述反应体系中加入催化剂,化学反应速率增大,E1和E2均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
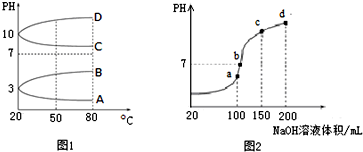
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
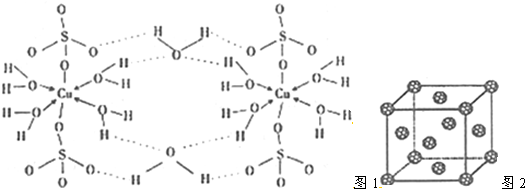
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚乙烯的结构简式: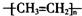 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com